
 的单体为
的单体为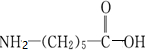 ,反应类型为缩聚反应.
,反应类型为缩聚反应. 科目:高中化学 来源: 题型:选择题
| A. | 乙烯聚合为聚乙烯高分子材料 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 以铜和浓硫酸为原料生产硫酸铜 | D. | 以铜和浓硝酸为原料生产硝酸铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
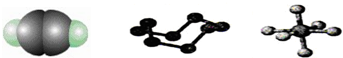
| A. | 32 g S8分子中含有0.125 mol σ键 | |
| B. | SF6是由极性键构成的非极性分子 | |
| C. | 1 mol C2H2分子中有3 mol σ键和2 mol π键 | |
| D. | 1 mol S8中含有8 mol S-S键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物都是强电解质 | |
| B. | 水溶液能导电的物质都是电解质 | |
| C. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| D. | 浓度一定的强电解质溶液,升高温度时其导电性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
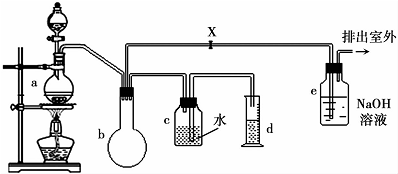
| 名称 | 熔点 | 沸点 | 溶解性 |
| 一氯甲烷 | -97.73℃ | -24.2℃ | 18℃时在水中微溶,与乙醚、丙酮或苯互溶,能溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
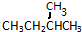
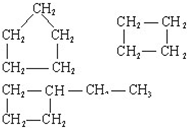 E.
E.

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
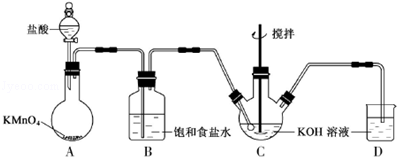
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
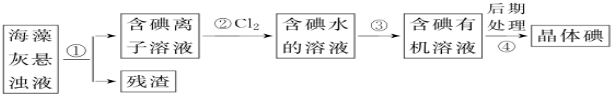
| A. | 步骤①、③的操作分别是过滤、萃取 | |
| B. | 可用硝酸银溶液检验步骤②的反应是否进行完全 | |
| C. | 步骤③中加入的有机溶剂是裂化汽油或四氯化碳 | |
| D. | 步骤④的操作是过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,原溶液含有SO42- | |
| B. | 某溶液先用稀硝酸酸化,再加入AgNO3溶液后有白色沉淀生成,证明原溶液中含有Cl- | |
| C. | 加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有NH4+ | |
| D. | 向某溶液中加入NaOH溶液,产生白色沉淀,白色沉淀迅速变成灰绿色,最终变成红褐色,说明原溶液中含有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com