
【题目】已知A为常见的金属单质,根据下图所示的关系:
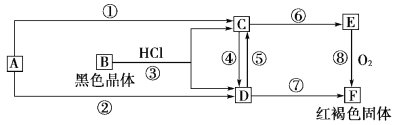
(1)确定A、B、C、D、E、F的化学式,A为________,B为________,C为________,D为________,E为________,F为________。
(2)写出⑧的化学方程式,④、⑤的离子方程式。
⑧_________________________________________________,
④________________________________________________,
⑤___________________________________________________。
【答案】Fe Fe3O4 FeCl2 FeCl3 Fe(OH)2 Fe(OH)3 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2Fe2++Cl2===2Cl-+2Fe3+ Fe+2Fe3+===3Fe2+
【解析】
由转化关系图可知,红褐色固体F为Fe(OH)3,则E为Fe(OH)2,C为FeCl2,D为FeCl3,A为Fe,B为Fe3O4,然后结合物质的性质及化学用语来解答。
:由转化关系图可知,红褐色固体F为Fe(OH)3,则E为Fe(OH)2,C为FeCl2,D为FeCl3,A为Fe,B为Fe3O4,
(1)由上分析知A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3,故答案为:Fe;Fe3O4;FeCl2;FeCl3;Fe(OH)2;Fe(OH)3;
(2)反应⑧为4Fe(OH)2的氧化,方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3,④的离子方程式为2Fe2++Cl2═2Fe3++2Cl-,⑤的离子方程式为2Fe3++Fe=3Fe2+,故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3、2Fe2++Cl2═2Fe3++2Cl-、2Fe3++Fe=3Fe2+。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的分子式或化学式,但知道它们在一定条件下具有如下的转换关系(未配平):
(1)G→Q十NaCl (2)Y十NaOH→G十Q十H2O
(3)Q+H2O![]() X+H2 (4)Z十NaOH→Q十X十H2O
X+H2 (4)Z十NaOH→Q十X十H2O
下列有关推断不正确的是( )
A.X一定不是次氯酸盐B.氧化性由弱到强的顺序为GYQZX
C.Z一定不是ClO4-D.G、Q、X、Y、Z均含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是
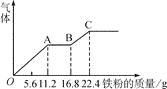
A. 图中,AB段的反应为Fe+2Fe3+=3Fe2+,溶液中溶质最终为FeSO4
B. 原溶液中H2SO4浓度为2.5 mol·L-1
C. 原混合溶液中NO3-的物质的量为0.2 mol
D. 图中,OA段产生的气体是NO,BC段产生的气体是氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
84消毒液
(有效成分)NaClO
(规格)1000ml
(质量分数)37.25%
(密度)1.2g.cm-3
(1)该“84消毒液”的物质的量浓度约为________mol·L-1(保留2位有效数字)。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)_____mol·L-1(保留小数点后2位)。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制230 mL含NaClO质量分数为37.25%的消毒液。
①需要称量NaClO固体的质量为___________g
②其操作步骤可分解为以下几步:
A.将称量准确的NaClO固体,放入烧杯里,加适量蒸馏水使其溶解,并用玻璃棒搅拌
B.用约30mL蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都倒入容量瓶里
C.将NaClO溶液小心地用玻璃棒引流容量瓶里D.检查250mL容量瓶,是否漏水
E.将蒸馏水直接加入容量瓶,至液面接近刻度线
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切
完成上述步骤中的空白处_____________________;正确的操作顺序是(用字母填写):_______________;进行A步骤操作时,必须__________后,才能进行后面的操作。
(4)“84消毒液”与稀硫酸混合使用可增加消毒能力,某消毒小组人员用98%(密度为1.84g/ml)的浓硫酸配制100ml4.6mol/L的稀硫酸,用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为__________mol/L;
②需要量取浓硫酸的体积为__________ml。
(5)将所配制的稀H2SO4进行测定,发现实际浓度小于4.6 mol·L-1。请你分析下列哪些操作会引起所配浓度偏小_______(填字母)。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.洗涤量筒中的液体注入烧杯
F.烧杯未进行洗涤
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),进行反应,2SO2+O22SO3,其起始物质的量及SO2的平衡转化率如下表所示.下列判断中正确的是( )
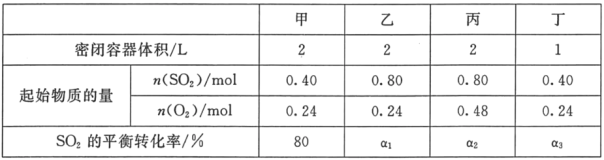
A.该温度下,该反应的平衡常数K为400
B.SO2的平衡转化率:a1>a2=a3
C.达到平衡时,容器丁中的正反应速率比容器丙中的大
D.达到平衡时,容器丙中c( SO3)大于容器甲中c( SO3)的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbCrO4是一种黄色颜料,制备PbCrO4的一种实验步骤如图1:
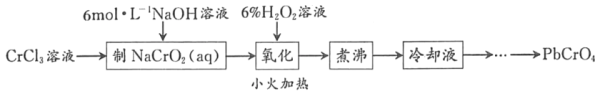
已知:①Cr(OH)3(两性氢氧化物)呈绿色且难溶于水
②Pb(NO3)2、Pb(CH3COO)2均易溶于水,PbCrO4的Ksp为2.8×10﹣13,Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7。
③六价铬在溶液中物种分布分数与pH关系如图2所示。
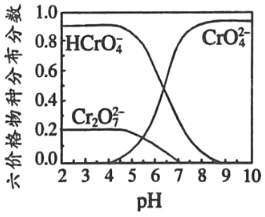
④PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液作用制得,含PbCrO4晶种时更易生成
(1)实验时需要配置100mL3molL﹣1CrCl3溶液,现有量筒、玻璃棒、烧杯,还需要玻璃仪器是___。
(2)“制NaCrO2(aq)”时,控制NaOH溶液加入量的操作方法是_____。
(3)“氧化”时H2O2滴加速度不宜过快,其原因是_____;“氧化”时发生反应的离子方程式为___。
(4)“煮沸”的目的是_____。
(5)请设计用“冷却液”制备PbCrO4的实验操作:_____[实验中须使用的试剂有:6molL﹣1的醋酸,0.5molL﹣1Pb(NO3)2溶液,pH 试纸]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同。则该混合气体中CO2、H2和CO的体积比为
A. 29∶8∶13 B. 22∶1∶14 C. 13∶8∶29 D. 44∶2∶28
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子共存或离子反应的说法正确的是
A.某无色溶液中可能大量存在H+、Cl-、MnO4-
B.pH=2的溶液中可能大量存在Na+、NH4+、CO32-
C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D.稀硫酸和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com