
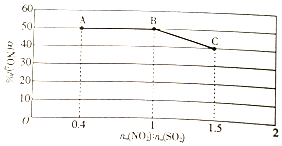
 已知NO2与以SO2能发生反应:NO2(g)+SO2(g)?SO3(g)+NO(g).
已知NO2与以SO2能发生反应:NO2(g)+SO2(g)?SO3(g)+NO(g).分析 (1)能跟碱反应生成盐和水,称为酸性氧化物,注意该反应不能是氧化还原反应;
(2)已知:①2NO(g)+O2(g)=2NO2(g)△H1=-113.0kJ•mol-1
②2SO2(g)+O2(g)?2SO3(g)△H2=-196.6kJ•mol-1
依据盖斯定律,$\frac{1}{2}$×(②-①)可得NO2(g)+SO2(g)?SO3(g)+NO(g)△H=$\frac{1}{2}×$(△H2-△H1);
(3)①a.根据PV=nRT分析P是否是一个变量;
b.根据M=$\frac{m}{n}$分析M是否是一个变量;
c.根据$ρ=\frac{m}{V}$分析ρ是否是一个变量;
d.NO2的体积分数等于物质的量分数;
②NO2(g)的起始浓度为0.4×c0mol/L,△c(NO2)=0.4×c0mol/L×50%,代入v=$\frac{△c}{△t}$计算;
③NO2(g)+SO2(g)?SO3(g)+NO(g)△H<0,增大原料气配比[n0(NO2):n0(SO2)],虽平衡正向移动,但a(NO2)减小,降低温度,平衡正向移动a(NO2)增大;
(4)将NO2与SO2的混合气体[n0(NO2):n0(SO2)=1]通入2mL0.1mol/L氯化钡溶液中,所得沉淀为硫酸钡,c(SO42-)=$\frac{Ksp(BaS{O}_{4})}{c(B{a}^{2+})}$,混合气体的物质的量n=2n(SO2)=2n(SO42-)=2×c(SO42-)×2×10-3L,代入V=n•Vm计算体积.
解答 解:(1)SO3、SO2、NO2都能与碱反应生成盐和水,但NO2与碱反应生成盐和水的反应属于氧化还原反应,所以SO3、SO2属于酸性氧化物,
故答案为:SO3、SO2;
(2)已知:①2NO(g)+O2(g)=2NO2(g)△H1=-113.0kJ•mol-1
②2SO2(g)+O2(g)?2SO3(g)△H2=-196.6kJ•mol-1
依据盖斯定律,$\frac{1}{2}$×(②-①)可得NO2(g)+SO2(g)?SO3(g)+NO(g)△H=$\frac{1}{2}×$(-196.6kJ•mol-1+113.0kJ•mol-1)=-41.8KJ/mol,
故答案为:-41.8KJ/mol;
(3)①a.PV=nRT,当温度不变时,P是一个定值,因此气体的压强不变不能说明反应达到了化学平衡状态;
b.M=$\frac{m}{n}$,气体的质量m是定值,气体的物质的量n是定值,则M是一个定值,因此气体的平均摩尔质量不变不能说明反应达到了化学平衡状态;
c.$ρ=\frac{m}{V}$,气体的质量m是定值,容积V恒定,则ρ是一个定值,因此气体的密度不变不能说明反应达到了化学平衡状态;
d.NO2的体积分数等于物质的量分数,从反应开始到平衡过程中,NO2的体积分数一直减小,因此NO2的体积分数不变可以说明反应达到了化学平衡状态;
故答案为:d;
②因为n0(NO2):n0(SO2)=0.4、恒容,所以A点对应的实验中NO2(g)的起始浓度为0.4×c0mol/L=$\frac{2{c}_{0}}{5}$mol/L,△c(NO2)=0.4×c0mol/L×50%=$\frac{{c}_{0}}{5}$mol/L,
v(NO2)=$\frac{\frac{{c}_{0}}{5}mol/L}{tmin}$=$\frac{{c}_{0}}{5t}$mol/(L•min),
故答案为:$\frac{{c}_{0}}{5t}$;
③NO2(g)+SO2(g)?SO3(g)+NO(g)△H<0,增大原料气配比[n0(NO2):n0(SO2)],虽平衡正向移动,但a(NO2)减小,降低温度,平衡正向移动a(NO2)增大,所以图示中,A点平衡状态通过增大原料气配比和降低温度变为B点的平衡状态,B点的平衡状态通过增大原料气配比变为C点的平衡状态;
所以若要使图中C点的平衡状态变为B 点的平衡状态,则应采取的措施是将NO2和SO2的物质的量之比调节为1:1,若要使图中A点的平衡状态变为B 点的平衡状态,则应采取的措施是将NO2和SO2物质的量之比调节为1:1的同时降低温度,
故答案为:将NO2和SO2的物质的量之比调节为1:1;将NO2和SO2物质的量之比调节为1:1的同时降低温度;
(4)NO2和SO2反应的SO3与氯化钡溶液反应生成BaSO4沉淀,不断消耗SO3,可逆反应趋向反应完全;
c(SO42-)=$\frac{Ksp(BaS{O}_{4})}{c(B{a}^{2+})}$=$\frac{1.0{×10}^{-9}}{1.0×1{0}^{-5}}$mol/L=1.0×10-4mol/L,
n(SO2)=n(SO42-)=1.0×10-4mol/L×2×10-3L=2.0×10-7mol,
因为n0(NO2):n0(SO2)=1,所以混合气体的物质的量n=2n(SO2)=2×2.0×10-7mol=4.0×10-7mol,
所以通入的混合气体在标准状况下的体积V=n•Vm=4.0×10-7mol×22.4L/mol=8.96×10-6L,
故答案为:BaSO4;8.96×10-6.
点评 本题考查较为综合,涉及物质的分类、反应热、化学反应速率和化学平衡常数的计算、化学平衡状态的判定、化学平衡与图象的关系等核心知识,为高频考点,难度较大,其中(3)③、(4)为该题的难点.


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 稀HNO3中加入过量的Fe 粉,充分反应后,滴入KSCN 溶液 | 溶液呈红色 | 稀HNO3将Fe 氧化为Fe3+ |
| B | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是K2CO3 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| D | Al 箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密了氧化膜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(l)△H<-867.0 KJ•mol-1 | |
| B. | 若增加甲烷的用量,平衡后体系中CO2的百分含量不一定升高 | |
| C. | 使用催化剂,可以降低反应的活化能,减少反应所放出的热量 | |
| D. | 标准状况下4.48 L CH4参加反应,转移电子数为1.6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 候氏制碱、制取肥皂的工艺过程中均应用了物质溶解度的差异 | |
| B. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦提取青蒿素的过程中发生了化学变化 | |
| C. | “外观如雪,强烧之,紫青烟起”,南北朝陶弘景对硝酸钾的鉴定过程中利用了焰色反应 | |
| D. | 使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺等都是绿色化学的内容 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 用铂丝蘸取溶液X进行焰色反应实验 | 火焰呈黄色 | 溶液X一定是钠盐溶液 |
| B | 将Cl2通入石蕊试液中 | 溶液先变红后褪色 | Cl2具有漂白性 |
| C | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和气体产生 | AlO2-与HCO3-发生了双水解反应 |
| D | 向FeBr2溶液中加入少量氯水,再加 CCl4振荡 | CCl4层无色 | Fe2+的还原性强于Br- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
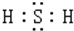 ,H2S的水溶液在空气中放置时,会逐渐变浑浊,这说明还H2S有强的还原性.
,H2S的水溶液在空气中放置时,会逐渐变浑浊,这说明还H2S有强的还原性.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
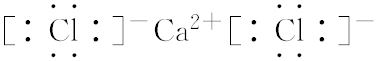 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com