
 在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)?xC(g),符合如图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强,t表示时间).下列说法正确的是( )
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)?xC(g),符合如图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强,t表示时间).下列说法正确的是( )| A、此反应为吸热反应 |
| B、a+b<x |
| C、T1<T2 |
| D、P1<P2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、海水中含有丰富的常量元素Mg和Br,以及微量元素I |
| B、流程②为:将MgCl2?6H2O在空气中受热分解制无水MgCl2 |
| C、在流程③④⑤中溴元素均被氧化 |
| D、流程①中欲除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,操作步骤为:依次加入Na2CO3溶液、NaOH溶液、BaCl2溶液,然后过滤,最后加入盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑤ | B、②③④⑥⑦ |
| C、①②③④ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
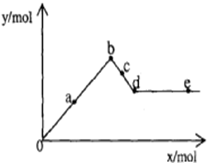 已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述错误的是( )
已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述错误的是( )| A、d-e 时溶液中离子的物质的量:Ba2+可能等于AlO2- |
| B、b-c 时溶液中离子的物质的量:AlO2-比Ba2+多 |
| C、a-d 时沉淀的物质的量:Al(OH)3一定小于BaSO4 |
| D、a-b 时沉淀的物质的量:Al(OH)3比BaSO4多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、③⑤ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+、Ag+、Mg2+ |
| 阴离子 | NO3-、CO32-、SiO32-、SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀HCl | 产生白色沉淀并放出0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 在Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
| 阴离子 | NO3- | CO32- | SiO32- | SO42- |
| c/mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳与二氧化碳在高温条件下反应 |
| B、Ba(OH)2?8H2O与NH4Cl的反应 |
| C、乙炔在O2中的燃烧 |
| D、氢氧化钠与稀盐酸反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com