
| A.用蒸馏法能从海水中提取淡水 |
| B.从海水中可以得到氯化镁,再加热分解可制金属镁 |
| C.用氯气从海水中提溴的关键反应是Cl2+2Br-= 2Cl-+Br2 |
D.煤的气化主要反应是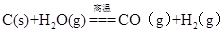 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 溴蒸气
溴蒸气
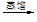 液溴
液溴 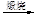
 石灰乳
石灰乳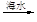
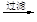
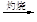 MgO
MgO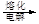 镁
镁
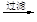 滤液
滤液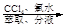 含碘有机溶液
含碘有机溶液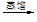 碘晶体
碘晶体
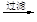
 精盐
精盐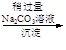
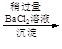
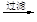 滤液
滤液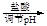
 食盐晶体
食盐晶体查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
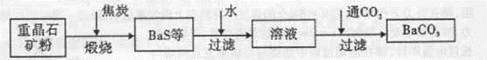
 BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题

| | SrSO4 | BaSO4 | Sr(OH)2 |
| Ksp | 3.3×10—7 | 1.1×10—10 | 3.2×10—4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 冶炼原理 | 方法 |
| A | 2HgO 2Hg + O2 ↑ 2Hg + O2 ↑ | 热分解法 |
| B | 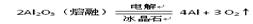 | 电解法 |
| C | Cu2S+ O2 2Cu + SO2 2Cu + SO2 | 热分解法 |
| D | Fe2O3 + 2Al 2 Fe + Al2O3 2 Fe + Al2O3 | 热还原法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
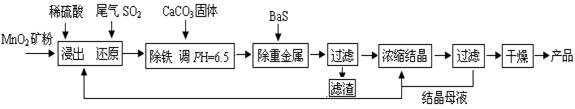
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解法热分解法热还原法 | B.热还原法热分解法电解法 |
| C.电解法热还原法热还原法 | D.电解法电解法热分解法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com