
 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)| c6(CO) |
| c2(N2) |
| c6(CO) |
| c2(N2) |
| 1 |
| 3 |
| 1 |
| 3 |


科目:高中化学 来源: 题型:

| [O] |
| [O] |
 与HC≡CH发生类似①的反应,生成含有三个苯环的化合物Ⅵ,写出化合物Ⅵ的结构简式
与HC≡CH发生类似①的反应,生成含有三个苯环的化合物Ⅵ,写出化合物Ⅵ的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、湿润的红色石蕊试纸遇二氧化硫变蓝色 |
| B、酚酞试液滴入稀硫酸溶液中显红色 |
| C、氯气使干燥的红布条褪色 |
| D、葡萄糖溶液中滴加新制氢氧化铜溶液出现砖红色色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
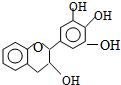 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图.关于EGC的下列叙述中正确的是( )| A、分子中所有的原子共面 |
| B、1mol EGC能与4mol NaOH反应 |
| C、可以发生氧化反应、取代反应、加成反应、消去反应 |
| D、能与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HCl物质的量浓度(mol?L-1) | AOH物质的量浓度(mol?L-1) | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.1 | c | pH=7 |
| 丙 | 0.1 | 0.1 | pH=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
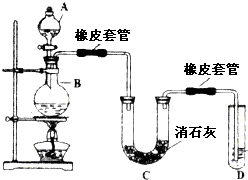 瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(该反应是放热反应),据此回答下列问题:
瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(该反应是放热反应),据此回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com