
【题目】下列表述正确的是( )
A.“青矾(绿矾)厂气熏人,衣服当之易烂,栽木不盛”。青矾厂气是![]() 和
和![]()
B.杜康用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来
C.“信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾”,其中涉及的操作有结晶
D.推广使用煤液化技术可以减少温室气体二氧化碳的排放
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】高能固氮反应条件苛刻,计算机模拟该历程如图所示,在放电的条件下,微量的O2或N2裂解成游离的O或N原子,分别与N2和O2发生以下连续反应生成NO。下列说法错误的( )
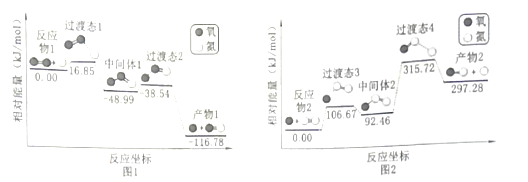
A.图1中,中间体1到产物1的方程式为O-O═N→O+N═O
B.NO的生成速率很慢是因为图2中间体2到过渡态4的能垒较大
C.由O和N2制NO的活化能为315.72kJmol-1
D.由N和O2制NO的过程比由O原子和N2制NO的过程速率慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。回答下列问题
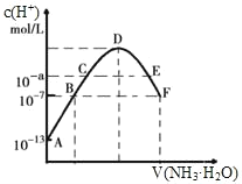
①NaHB溶液呈_______(填“酸性”“碱性”或“中性”)
②A、D、E三点溶液的pH由大到小为:_______
③F点溶液c(NH4+)_______2c(B2-)(填“>”“<”或“=”)
(2)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/LNaOH溶液,制得等量Mg(OH)2沉淀。
①分别向两支试管中加入不同试剂,请填写下表中的实验现象(用下列选项中字母代号填写)
试管编号 | 加入试剂 | 实验现象 |
Ⅰ | 2滴0.1mol/LFeCl3溶液 | _______ |
Ⅱ | 4mL2mol/LNH4Cl溶液 | _______ |
A 白色沉淀转化为红褐色沉淀 B 白色沉淀不发生改变
C 红褐色沉淀转化为白色沉淀 D 白色沉淀溶解,得无色溶液
②同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的沉淀溶解平衡正向移动。猜想2:_______。
(3)为验证猜想,同学们取少量相同质量的氢氧化镁固体盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明正确的是_______(填“猜想1”或“猜想2”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L带气压计的恒容密闭容器中通入2 molX(g)和1molY(g),发生反应:2X(g)+Y(g)![]() 2Z(g) ΔH<0。若达到平衡时气体总物质的量变为原来的0.85倍,请回答下列问题。
2Z(g) ΔH<0。若达到平衡时气体总物质的量变为原来的0.85倍,请回答下列问题。
(1)若反应经历5min达到平衡,则Y的平均反应速率为__。
(2)相同条件下进行反应,在t1时刻,只改变下列某一种条件,其曲线图象如图甲。
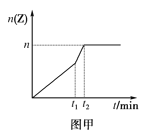
若n=0.9mol,t1时刻改变的条件是__(填选项编号,A.升温 B.降温 C.加压 D.减压 E.加催化剂),t2__5min(填“>”“<”或“=”,下同)。
(3)若其他条件不变,原容器为恒压容器,达到平衡后Z的物质的量__0.9mol。
(4)若将物质的量均为3mol的物质X、Y混合于5L容器中发生反应,在反应过程中Z的物质的量分数随温度变化如图乙。
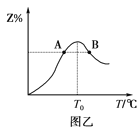
①A、B两点Z物质正反应速率的大小关系是__;(速率用A、B表示)
②温度T<T0时,Z%逐渐增大的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)常温下,将等浓度的Na2S2O3溶液与硫酸溶液混合,2 min后溶液中明显出现浑浊,请写出相关反应的离子方程式:__________________________________________;若将此混合溶液置于50℃的水浴中,则出现浑浊的时间将__________ (填“增加”、“减少”或“不变”)。
(2)已知![]() 的电离平衡常数
的电离平衡常数![]() ,向0.1mol/L
,向0.1mol/L![]() 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至![]() 1:18,此时溶液PH=________。
1:18,此时溶液PH=________。
(3)CO2与CH4经催化重整,制得合成气CO和H2:
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的热化学反应方程式为:___________________________。分别在v L恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______(填“A” 或“B ”)。
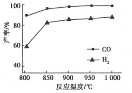
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如下图所示。此反应优选温度为900℃的原因是_________________________________。
(4)已知2CH3OH(g) ![]() CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c / mol·L-1 | 0.4 | 0.1 | 0.1 |
①此时,反应向___________ (填“左”或“右”)移动,才能达到平衡。
②从加入CH3OH开始反应到20min时,CH3OCH3的生成速率为_____________。
③达到平衡后CH3OH的浓度为_____________。
(5)制取聚乙二酸乙二酯的反应方程式_______________________________
(6)有一种耐热型树脂材料![]() 结构简式为
结构简式为![]() ,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:__________。
,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:__________。
(7)有机物R(C6H12O2)与稀硫酸共热生成A和B,A能够发生银镜反应,B不能发生催化氧化反应,那么R的结构简式为_________。
(8)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]的反应历程,如图所示,其中吸附在金催化剂表面上的物种用标注。
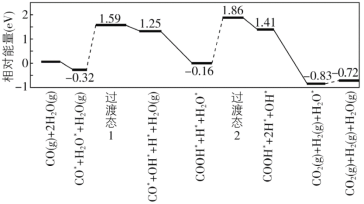
可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________eV,写出该步骤的化学方程式_______________________。
(9)某有机物A由C、H、O三种元素组成,相对分子质量为90 .将9.0gA完全燃烧的产物依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,A能与NaHCO3溶液反应,且2分子A之间脱水可生成八元环化合物.则A在一定条件下发生缩聚反应的产物的结构简式是:_________________________
(10)已知: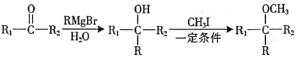 (R表示烃基,R1、R2表示烃基或氢原子)。设计以
(R表示烃基,R1、R2表示烃基或氢原子)。设计以![]() 为原料制备
为原料制备![]() 的合成路线(提供CH3MgBr及需要的无机试剂)_______________________________________________________________。
的合成路线(提供CH3MgBr及需要的无机试剂)_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A-F是几种典型有机代表物的分子模型,请看图回答下列问题。
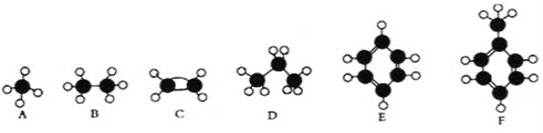
(1)常温下含碳量最高的是________(填对应字母);
(2)A、B、D三种物质的关系为____________
(3)写出F与浓硝酸和浓硫酸的混合物共热生成TNT的反应方程式__________
(4)写出E与溴反应的化学方程式________________;
(5)写出C使溴水褪色的方程式 ___________
(6)写出C的官能团的名称______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T是一种有机药物,其合成路线如图:

已知:① ;
;
②
(1)Z中含氧官能团的名称为_______________。
(2)R的分子式为_________,R经过反应可生成S,写出S的结构简式:__________________。
(3)![]() 的反应方程式为________________、
的反应方程式为________________、![]() 的反应类型为________________。
的反应类型为________________。
(4)W是T的一种同分异构体,满足下列条件的W的结构有______________种,写出其中一种的结构简式:___________________________。
①能发生银镜反应;
②能发生水解反应,其水解产物之一能与![]() 溶液发生显色反应;
溶液发生显色反应;
③分子中只有4种不同化学环境的氢。
(5)结合本题信息,请以2-甲基-1-丙醇( )、苯为原料来合成X,写出有关的合成路线流程图(无机试剂任选)____________。合成路线流程图示例如下:
)、苯为原料来合成X,写出有关的合成路线流程图(无机试剂任选)____________。合成路线流程图示例如下:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
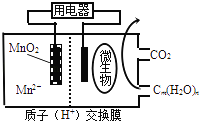
A.放电过程中,H+从正极区移向负极区
B.分子组成为Cm(H2O)n的物质一定是糖类
C.微生物所在电极区放电时发生还原反应
D.左边电极反应式为:MnO2+4H++2e﹣=Mn2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二醛(OHC-CHO)是一种重要的精细化工产品。长郡中学高三化学兴趣小组利用乙醛液相硝酸氧化法制备乙二醛并测定乙二醛纯度,装置如图所示。
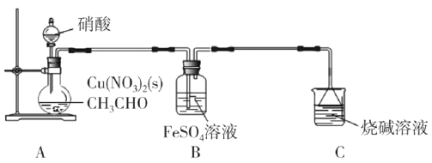
已知:①NO+FeSO4=FeSO4·NO(棕色)。
②几种有机物的部分性质如表所示:

实验步骤:
①取20mL的乙醛装于烧瓶,加入2gCu(NO3)2粉末作催化剂,向烧瓶中缓慢滴加2mol·L-1硝酸至乙醛完全反应为止;
②提纯产品,最终得到10.0mL产品。
请回答下列问题:
(1)盛装硝酸的仪器名称是__。
(2)实验中,观察到装置B中溶液变为棕色,制备乙二醛的化学方程式为__。
(3)向烧瓶中滴加硝酸要“缓慢”,其目的是__;判断烧瓶中制备乙二醛的反应已完成的标志是__。
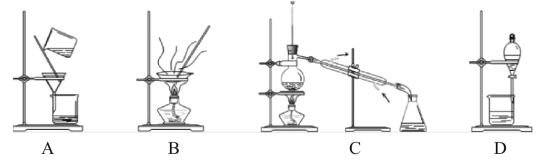
(4)分离提纯产品,宜选择下列装置__(填字母)。
(5)根据上述实验数据,该实验中乙二醛的产率约为__(填字母)。
a.56.5% b.61.8% c.67.9% d.72.6%
(6)实验室可用酸性KMnO4溶液测定乙二醛的纯度,发生反应的离子方程式为:18H++6MnO4-+5C2H2O2→10CO2↑+6Mn2++14H2O。实验步骤如下:取VmL产品,加蒸馏水稀释至250mL,量取25.00mL稀释后的溶液于锥形瓶,滴加5.00mL稀硫酸,用cmol·L-1KMnO4溶液,三次平行实验消耗KMnO4溶液体积如下:
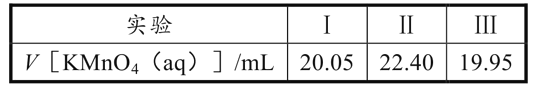
滴定终点的标志是__;该产品纯度为___g·mL-1(用含V和c的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com