
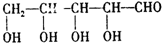
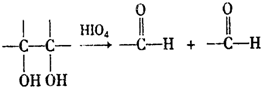
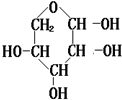
 ,
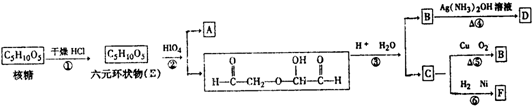
, 和高碘酸反应生成A和
和高碘酸反应生成A和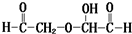 ,根据题给信息知,A的结构简式为:HCOOH,
,根据题给信息知,A的结构简式为:HCOOH,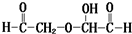 在酸性条件下和水反应生成B和C,根据题给信息知,生成物是OHCCH2OH和OHCCHO,B能发生银镜反应生成D,C能再Cu作催化剂条件下被氧化生成B,则B是OHCCHO,C是OHCCH2OH,D为HOOCCOOH,E是HOCH2CH2OH,(6)中某有机物是C的同系物,其相对分子质量为88,该同系物分子中比C多CH2原子团数目为
在酸性条件下和水反应生成B和C,根据题给信息知,生成物是OHCCH2OH和OHCCHO,B能发生银镜反应生成D,C能再Cu作催化剂条件下被氧化生成B,则B是OHCCHO,C是OHCCH2OH,D为HOOCCOOH,E是HOCH2CH2OH,(6)中某有机物是C的同系物,其相对分子质量为88,该同系物分子中比C多CH2原子团数目为| 88-12×2-4-16×2 |
| 14 |
 ,
, 和高碘酸反应生成A和
和高碘酸反应生成A和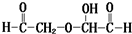 ,根据题给信息知,A的结构简式为:HCOOH,
,根据题给信息知,A的结构简式为:HCOOH,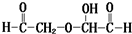 在酸性条件下和水反应生成B和C,根据题给信息知,生成物是OHCCH2OH和OHCCHO,B能发生银镜反应生成D,C能再Cu作催化剂条件下被氧化生成B,则B是OHCCHO,C是OHCCH2OH,D为HOOCCOOH,E是HOCH2CH2OH,
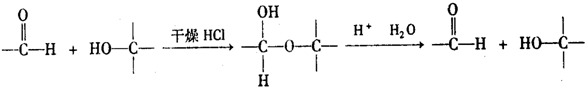
在酸性条件下和水反应生成B和C,根据题给信息知,生成物是OHCCH2OH和OHCCHO,B能发生银镜反应生成D,C能再Cu作催化剂条件下被氧化生成B,则B是OHCCHO,C是OHCCH2OH,D为HOOCCOOH,E是HOCH2CH2OH,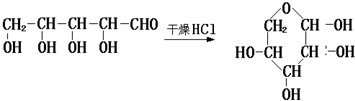 ,属于加成反应,
,属于加成反应, ,加成反应;
,加成反应;| △ |
| △ |
| 88-12×2-4-16×2 |
| 14 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
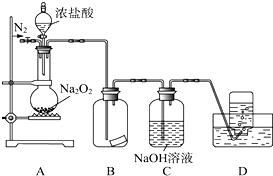 某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.实验步骤及现象如下:
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.实验步骤及现象如下: Na2O2+
Na2O2+ HCl═
HCl═ Cl2+
Cl2+ NaCl+
NaCl+
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、哈伯法合成氨是吸热反应,新法合成氨是放热反应 |
| B、新法合成氨不需要在高温条件下,可节约大量能源,具有发展前景 |
| C、新法合成氨能在常温下进行是因为不需要断裂化学键 |
| D、新催化剂降低了反应所需要的能量,使平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 |
| B、H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 |
| C、在H2O2分解过程中,溶液的pH逐渐下降 |
| D、H2O2生产过程中加入少量Fe2+可以提高产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com