
| A. | 炭粉和二氧化硅均匀混和后强热 | B. | 石英和纯碱均匀混和后强热 | ||
| C. | 二氧化锰和浓盐酸混和加热 | D. | 锌粒加入到稀硫酸中 |
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2O | B. | Na2O2 | C. | Na2O和Na2O2 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)中国古代四大发明之一--黑火药,它的爆炸反应为S+3C+2KNO3$\frac{\underline{\;点燃\;}}{\;}$K2S+3CO2↑+N2↑.
(1)中国古代四大发明之一--黑火药,它的爆炸反应为S+3C+2KNO3$\frac{\underline{\;点燃\;}}{\;}$K2S+3CO2↑+N2↑.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Si、SiO2、H2SiO3、Na2SiO3 | B. | Fe2O3、Fe、FeCl2、FeCl3 | ||
| C. | Cu、CuO、Cu(OH)2、CuSO4 | D. | Na、Na2O2、NaOH、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:K+、Cu2+、Na+、SO42- | |
| B. | 加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、NH4+ | |
| C. | 强酸性溶液中:Fe2+、Al3+、NO3-、Cl- | |
| D. | 酚酞试液显红色的溶液中:Ba2+、Na+、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
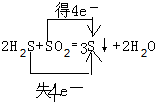 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/(mol•L-1) | 0.1 | 0.2 | 0 |
| 平衡浓度/(mol•L-1) | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 该反应的化学方程式为3X(g)+Y(g)?2Z(g) | |
| C. | 25℃时,该反应的平衡常数为1600 | |
| D. | 改变温度可以改变此反应的平衡常数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com