


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
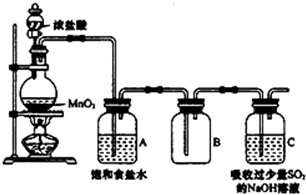 某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:
某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol/L H2SO4溶液至溶液呈酸性,然后将所得溶液分别置于A、B试管中 | / |
| 步骤2: | Ⅰ: Ⅱ: |
| 步骤3: | Ⅰ: Ⅱ: |
查看答案和解析>>
科目:高中化学 来源: 题型:
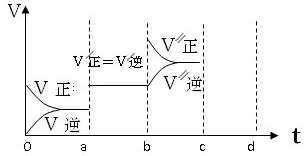 在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:| 物 质 | A | B | C |
| 初始浓度/mol?L-1 | 1.0 | 2.0 | 0 |
| 2min时,平衡浓度/mol?L-1 | 0.4 | 0.2 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 欲配制500mL0.2mol/LNa2CO3溶液,回答下列问题:
欲配制500mL0.2mol/LNa2CO3溶液,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 通入O2 |
| 通入空气吹出Br2 |
| 用X吸收 |
| 通入Cl2 |
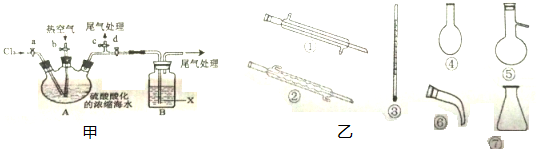
查看答案和解析>>
科目:高中化学 来源: 题型:
A、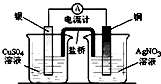 装置可将化学能转化为电能 |
B、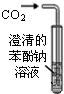 装置可用于比较碳酸、苯酚酸性的强弱 |
C、 装置可用来进行浓硫酸的稀释 |
D、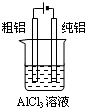 装置可用于电解精炼铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ |
| B、只有①②③ |
| C、只有①②③④ |
| D、只有①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com