
【题目】B、C、N、Mg、Al、Si均是重要短周期元素,其化合物在工业中有重要用途。请回答下列问题:
(1)硼氢化合物B2H6的结构如图所示,则B原子的杂化方式为___。2个硼原子与4个氢原子形成普通的σ键。这四个σ键在同一平面上,另外两个氢原子和这两个硼原子形成了两个垂直于该平面的“氢桥键”,该“氢桥键”为___中心___(原子)电子键(填阿拉伯数字)。
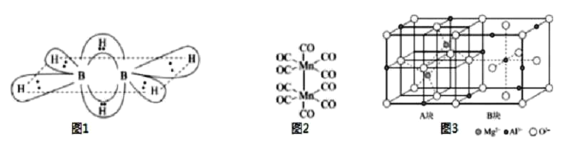
(2)CF4和PF3的沸点比较CF4___PF3(选填“>”或“<”)。PCl5中P原子采用sp3d杂化,形成三角双锥结构,而N原子只能形成NCl3,不能形成NCl5的原因是___。
(3)基态Mn原子核外特征电子排布式为___;已知CO的结构为C![]() O,Mn2(CO)10(结构如图2)中π键与配位键的个数比为___。
O,Mn2(CO)10(结构如图2)中π键与配位键的个数比为___。
(4)环状基型硅酸盐中硅氧四面体共角氧相连,并封闭成环,分单层环与双层环两大类,双层三环Si6O15,双层四环Si8O20、双层六环Si12O30、双层n环Si2nOm,当n=10时,m=___。
(5)尖晶石的结构如图3所示,请写出尖晶石的化学式___;A块、B块均为边长为apm的立方体,设阿伏伽德罗常数的值为NA,最近两个Al3+之间的距离为___pm,尖晶石的密度为___g/cm3(列出计算式)。
【答案】sp3 3 2 < N原子最外层无d轨道,不能发生sp3d杂化,不能形成NCl5 3d54s2 2:1 50 MgAl2O4 ![]() a
a ![]()
【解析】
根据化合物结构及共价键结构,判断原子杂化类型;分子晶体,根据相对分子质量比较沸点;根据元素周期表位置书写核外电子排布式;根据晶胞密度公式进行计算。
(1)硼氢化合物B2H6的结构如图,则B原子的杂化方式为sp3。2个硼原子与4个氢原子形成普通的σ键。这四个σ键在同一平面上,另外两个氢原子和这两个硼原子形成了两个垂直于该平面的“氢桥键”,该“氢桥键”为3中心2(原子)电子键。
(2) 对于分子晶体,相对分子质量越大,熔沸点越高,CF4和PF3的沸点比较CF4<PF3。PCl5中P原子采用sp3d杂化,形成三角双锥结构,而N原子只能形成NCl3,不能形成NCl5的原因是N原子最外层无d轨道,不能发生sp3d杂化,不能形成NCl5。
(3)锰原子序数为25,基态Mn原子核外特征电子排布式为3d54s2;已知CO的结构为C![]() O,三键中含有1个σ键和2个π键,锰原子和碳原子形成配位键,Mn2(CO)10中π键与配位键的个数比为2:1。
O,三键中含有1个σ键和2个π键,锰原子和碳原子形成配位键,Mn2(CO)10中π键与配位键的个数比为2:1。
(4)环状基型硅酸盐中硅氧四面体共角氧相连,并封闭成环,分单层环与双层环两大类,双层三环Si6O15,双层四环Si8O20、双层六环Si12O30,根据规律,双层n环Si2nOm,当n=10时,m=![]() =50。
=50。
(5)由尖晶石的结构可知,结构中氧离子作面心立方最紧密堆积,镁离子填充在四面体空隙,铝离子占据八面体空隙,晶胞中有8个分子,尖晶石的化学式MgAl2O4;A块、B块均为边长为apm的立方体,A块显示镁离子占据四面体空隙情况,B块表示铝离子占据四面体空隙情况,设阿伏伽德罗常数的值为NA,最近两个Al3+之间的距离为![]() a pm,尖晶石的密度为
a pm,尖晶石的密度为![]() g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】用下图表示的一些物质或概念间的从属关系中正确的是
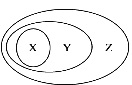
X | Y | Z | |
A | 水 | 单质 | 纯净物 |
B | 非金属氧化物 | 酸性氧化物 | 氧化物 |
C | 电解质 | 化合物 | 纯净物 |
D | 化合反应 | 氧化还原反应 | 化学反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示测定溶液导电性实验的装置,甲与乙中盛有浓度相同的不同液体。接通电源后将甲中液体逐滴滴入乙中,发现灯泡由亮→暗灭→亮。下表中甲、乙所盛液体符合要求的是( )

选项 | 甲 | 乙 |
A | 氯化钠溶液 | 硝酸银溶液 |
B | 氨水 | 醋酸 |
C | 稀盐酸 | 碳酸钙悬浊液 |
D | 硫酸铜溶液 | 氢氧化钡溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.22.4L CO2与足量Na2O2反应转移的电子数为NA
B.1mol·L-1的NaOH溶液中含Na+数目为NA
C.78gNa2O2晶体中含有的阴离子数目为2NA
D.a g CO和H2的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙二醇(PEG)是一种非离子性惰性溶剂和绿色有机合成的重要催化剂,如图是合成PEG等的简单流程,其中E是一种聚碳酸酯高分子化合物。
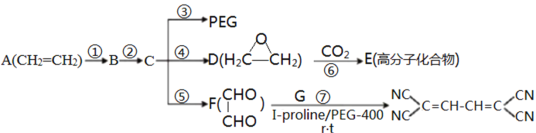
已知①RCH2Cl![]() RCH2CN
RCH2CN
②R’CHO+RCH2CN![]() +H2O
+H2O
请根据以上信息回答下列问题:
(1)反应②所需的试剂和反应条件___;反应⑥的反应类型是___。
(2)物质F的名称为___。
(3)物质E的结构简式为___;反应⑦的另一种产物为水,则G的结构简式为___。
(4)反应③的化学方程式为___。
(5)M与D的组成元素相同,且M中各原子数目为D中各原子数目的2倍,写出符合下列条件的M的结构简式___ (只写一种)。
a.能与新制的氢氧化铜悬浊液反应生成砖红色沉淀
b.能在稀硫酸中发生水解反应
(6)写出以乙烯为原料合成![]() 的路线图,其它无机试剂任选___。
的路线图,其它无机试剂任选___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作及现象所得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 测定等浓度的 | 前者pH比后者大 | 非金属性:S>C |
B | 将NaCl晶体分散在乙醇中,用激光笔照射 | 出现光亮的通路 | 该分散系为胶体 |
C | 向溶液中加入盐酸酸化的 | 产生白色沉淀 | 溶液中含有 |
D | 向填充有经硫酸处理的 | 固体由橙色变为绿色 | 乙醇具有氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 用途广泛。某探究小组同学以废铜屑(含杂质铁)为原料,在实验室用如图所示装置制取硫酸铜,再进一步从所得溶液中获得无水硫酸铜。
用途广泛。某探究小组同学以废铜屑(含杂质铁)为原料,在实验室用如图所示装置制取硫酸铜,再进一步从所得溶液中获得无水硫酸铜。

Ⅰ.制备![]() 晶体
晶体
(1)仪器M名称为________。
(2)将反应温度控制在70℃-80℃,可采用的加热方法是________。
(3)从反应后的混合溶液中获得硫酸铜晶体的操作步骤如下:
①向溶液中加入________(填标号)至稀溶液pH约为4,过滤。
a. CuO b. NaOH溶液 c.![]()
②将滤液________、________(填操作名称)过滤、用乙醇洗涤、低温干燥,得![]() 晶体。
晶体。
(4)用乙醇代替蒸馏水洗涤晶体的目的是________,并缩短干燥所需时间。
Ⅱ.制备无水![]()
(5)灼烧法:实验室可在________(填仪器名称)中灼烧![]() ,晶体制备无水
,晶体制备无水![]() 。
。
(6)![]() 法:该方案采用如下图装置,________(填操作名称)A使
法:该方案采用如下图装置,________(填操作名称)A使![]() 气体进入装有
气体进入装有![]() 晶体的硬质玻璃管(已知:
晶体的硬质玻璃管(已知:![]() 的熔点为-105℃、沸点为76℃、遇水剧烈水解生成两种酸性气体)。装置B中
的熔点为-105℃、沸点为76℃、遇水剧烈水解生成两种酸性气体)。装置B中![]() 和
和![]() 发生反应的化学方程式为________。
发生反应的化学方程式为________。
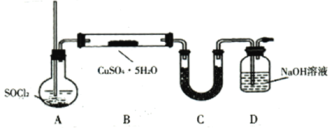
(7)![]() 法:相对灼烧法的优点为________________。(写出一点即可)
法:相对灼烧法的优点为________________。(写出一点即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种短周期元素A、B、C、D,它们的核电荷数依次增大。A与C,B与D分别是同主族元素。B、D质子数之和是A、C质子数之和的2倍。这四种元素中A、C、D的单质均可在B的单质中燃烧。
(1)A的元素名称是________,C的元素符号是________。
(2)D元素位于元素周期表的第______周期第______族。
(3)C元素的单质在B的单质中燃烧的产物的化学式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com