
| A. | -183 kJ•mol-1 | B. | +183 kJ•mol-1 | C. | -862 kJ•mol-1 | D. | +862 kJ•mol-1 |
科目:高中化学 来源: 题型:解答题
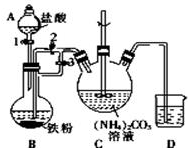 乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.
乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当△H为“-”时,表示该反应为吸热反应 | |
| B. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 | |
| C. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | |
| D. | 已知:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ/mol,碳的燃烧热为110.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤燃烧时并不能将化学能全部转化为热能 | |
| B. | 原电池将化学能转化为电能 | |
| C. | 二次电池放电时将电能转化为化学能 | |
| D. | 镁条燃烧时将部分化学能转化为光能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | A 溶液 | B 溶液 |
| ① | 20 mL 0.1 mol•L-1 H2C2O4 溶液 | 30 mL 0.01 mol•L-1KMnO4 酸性溶液 |
| ② | 20 mL 0.2 mol•L-1 H2C2O4 溶液 | 30 mL 0.01 mol•L-1 KMnO4酸性溶液 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
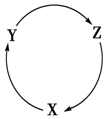 下列各组物质中,满足图中物质一步转化关系的选项是( )
下列各组物质中,满足图中物质一步转化关系的选项是( )| X | Y | Z | |
| A | CO | CO2 | H2CO3 |
| B | Cu | CuO | Cu(OH)2 |
| C | CaO | Ca(OH)2 | CaCO3 |
| D | H2SO4 | Na2SO4 | NaCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com