
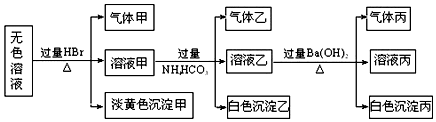
分析 由无色溶液加HBr产生淡黄色沉淀,该沉淀只能为S,则发生2S2-+SO32-+6H+=3S↓+3H2O,说明一定存在S2-、SO32-,根据离子共存可知一定不存在Ba2+、Al3+;CO32-和SO42-可能存在,根据溶液要呈电中性,故Na+一定存在;白色沉淀乙应为原溶液中含有的AlO2-与过量HBr反应生成Al3+与HCO3-发生双水解得到Al(OH)3,气体乙为二氧化碳,再加过量Ba(OH)2反应,因NH4HCO3过量,白色沉淀丙一定含碳酸钡,还可能有BaSO4,气体丙为氨气,
(1)结合可能存在的离子知,加入HBr后得到淡黄色沉淀一定S2-与SO32-在酸性条件下发生归中反应得到的单质硫;
(2)由(1)知,溶液中含S2-与SO32-,则一定不含Ba2+、Al3+,加入过量NH4HCO3后得到白色沉淀只能是原溶液中含有的AlO2-与过量HBr反应生成Al3+与HCO3-发生双水解得到Al(OH)3;
(3)沉淀丙即可能是剩余NH4HCO3与Ba(OH)2反应得到BaCO3,也可能是BaCO3与溶液可能含有的SO42-与Ba(OH)2反应得到BaSO4的混合物;因硫酸钡不溶于盐酸,因此可利用加入盐酸,观察固体溶解情况来判断固体成分;
(4)结合前面分析知一定含有S2-、SO32-、AlO2-,在利用电荷守恒可知必含Na+; 一定不含Ba2+、Al3+; 无法确定是否含有CO32-、SO42-.
解答 解:由无色溶液加HBr产生淡黄色沉淀,该沉淀只能为S,则发生2S2-+SO32-+6H+=3S↓+3H2O,说明一定存在S2-、SO32-,根据离子共存可知一定不存在Ba2+、Al3+;CO32-和SO42-可能存在,根据溶液要呈电中性,故Na+一定存在;白色沉淀乙应为原溶液中含有的AlO2-与过量HBr反应生成Al3+与HCO3-发生双水解得到Al(OH)3,气体乙为二氧化碳,再加过量Ba(OH)2反应,因NH4HCO3过量,白色沉淀丙一定含碳酸钡,还可能有BaSO4,气体丙为氨气,
(1)沉淀甲为单质硫,生成S的反应是溶液中S2-与SO32-在酸性条件下发生归中反应得到,所以生成沉淀甲的离子方程式为:2S2-+SO32-+6H+=3S↓+3H2O,
故答案为:2S2-+SO32-+6H+=3S↓+3H2O;
(2)溶液中含S2-与SO32-,则一定不含Ba2+、Al3+,而溶液甲与过量NH4HCO3后得到白色沉淀一定是Al(OH)3,产生该沉淀的原因一定是原溶液中含有的AlO2-与过量HBr反应生成Al3+与HCO3-发生双水解得到Al(OH)3,所以生成沉淀乙的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)沉淀丙即可能是剩余NH4HCO3与Ba(OH)2反应得到BaCO3,也可能是BaCO3与溶液可能含有的SO42-与Ba(OH)2反应得到BaSO4的混合物,故沉淀丙可能是:BaCO3或BaCO3与BaSO4的混合物;利用碳酸钡可溶于盐酸而硫酸钡不溶于盐酸的性质,利用向固体中加入盐酸,观察固体溶解情况来判断固体成分,故确定固体成分的方法是:在所得沉淀丙中加入稀盐酸,若沉淀全部溶解,说明沉淀丙是BaCO3,若沉淀仅部分溶解,说明沉淀是BaCO3和BaSO4的混合物,
故答案为:BaCO3或BaCO3与BaSO4的混合物;在所得沉淀丙中加入稀盐酸,若沉淀全部溶解,说明沉淀丙是BaCO3,若沉淀仅部分溶解,说明沉淀是BaCO3和BaSO4的混合物;
(4)根据分析可知一定含有离子为:S2-、SO32-、AlO2-、Na+; 一定不含的离子为:Ba2+、Al3+; 无法确定是否含有的离子为:CO32-、SO42-,
故答案为:Na+、S2-、SO32-、AlO2-;Ba2+、Al3+.
点评 本题考查无机推断,题目难度中等,涉及离子推断、离子方程式书写、物质检验方案的设计等知识,明确常见离子的性质为解答关键,试题有利于提高学生的分析、理解能力及逻辑推理能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<B<C | |
| B. | 三种元素的最高价氧化物对应水化物均可由化合反应得到 | |
| C. | A的氢化物稳定性小于C的氢化物稳定性 | |
| D. | B 和A的最高价氧化物可发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
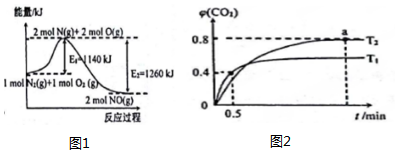
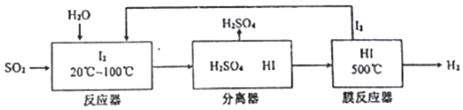
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
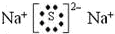 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量的CH3COONa | B. | 向水中加入少量的NaHSO4 | ||
| C. | 加热水至100℃,pH=6 | D. | 向水中加少量的明矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L | B. | 0.05mol/L | C. | 0.4mol/L | D. | 0.01mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com