

| A. | 甲中△H1=-(△H2+△H3) | |
| B. | 乙表示恒温恒容条件下发生的可逆反应2NO2(g)═N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| D. | 丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于等物质的量浓度的NaB溶液的pH |
分析 A.盖斯定律计算分析,反应焓变和过程无关;
B、依据图象中起点和变化趋势,结合化学平衡分析判断;
C、依据图象中曲线的变化趋势,和饱和溶液中溶质的质量分数计算分析判断;
D、PH相同的两种酸稀释后弱酸的PH增大的少分析判断;
解答 解:A.H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H1>0,H2O(g)=H2O(l)△H2<0,H2(g)+$\frac{1}{2}$O2(g)△H3<0,盖斯定律可知甲中△H1=-(△H2+△H3),故A正确;
B、图中二氧化氮和四氧化二氮气态都是从0开始,横坐标向右表示浓度增大 纵坐标向上表示物质消耗速率快,A点表示反应速率相等,不能确定平衡状态,如果达到平衡状态,则二者消耗速率之比等于化学计量数之比即应该等于2:1,此时才能够达到平衡状态,故B错误;
C、将A、B饱和溶液分别由t1℃升温至t2℃时两溶液中溶质和溶剂的量都不会改变 二者t1℃溶解度相同即浓度相同,所以t2℃时溶质的质量分数相等,故C错误;
D、图中两种酸PH相同,稀释HA、HB两种酸的稀溶液时,HA的PH增大的多,HBPH增大的少,说明HA酸的酸性强于HB的酸性,所以同浓度的NaA溶液水解程度小于NaB溶液,NaA溶液PH小于NaB溶液,故D正确;
故选AD.
点评 本题考查了各种图象的分析思路和变化特征的应用,主要是燃烧热的概念应用,平衡状态的判断,饱和溶液中溶质溶解度和质量分数的判断,弱酸稀释的PH变化判断酸的强弱,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氟气发生取代反应可以制得CH3F | |
| B. | CH3F分子中含有离子键 | |
| C. | CH3F分子中含有共价键和离子键 | |
| D. | CH3F的摩尔质量是34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 科学家研制的离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高、更安全、环保.下列说法不正确的是( )
科学家研制的离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高、更安全、环保.下列说法不正确的是( )| A. | 羟基硝酸铵中阳离子的各原子共平面 | |
| B. | 羟基硝酸铵易溶于水 | |
| C. | 羟基硝酸铵中含有离子键和共价键 | |
| D. | 9.6g羟基硝酸铵中含有0.2mol离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
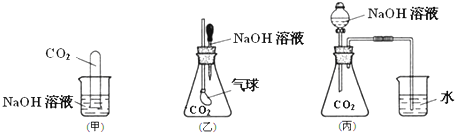
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子的电子层数比Y原子电子层数多 | |
| B. | X的氢化物的沸点比Y的氢化物沸点低 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | Y的单质能将X从NaX的溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
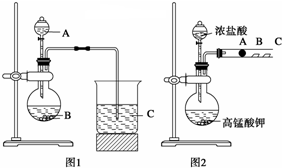
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
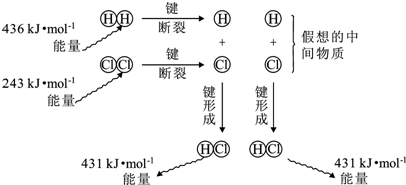
| A. | H-H键比Cl-Cl键强,H-Cl键是极性共价键 | |
| B. | 断键吸收能量,成键释放能量,该反应△H=-183kJ/mol | |
| C. | 若生成液态HCl,则反应释放的能量将减少 | |
| D. | 反应的焓变与假想的中间物质的种类、状态无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大反应体系的压强,反应速率不一定增大 | |
| C. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1mol/L、c2mol/L,则时间间隔t1min~t2min内,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$mol/L•min |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com