
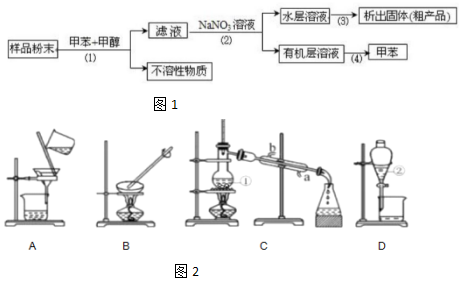
分析 (1)步骤(1)是分离固液混合物,其操作为过滤,步骤(2)分离互不相溶的液体混合物,需进行分液,要用到分液漏斗;步骤(3)是从溶液中得到固体,操作为蒸发,需要蒸发皿;步骤(4)是从有机化合物中,利用沸点不同采取蒸馏得到甲苯;
(2)①为蒸馏烧瓶,②为分液漏斗,①中是混合液体加热为防止暴沸需要加入碎瓷片;
(3)冷凝管中水流方向为逆流;
(4)常见能用分液漏斗分离的物质应是互不相溶的液体混合物;
(5)A装置是过滤,装置中玻璃棒是引流作用,B装置是蒸发浓缩结晶析出晶体,玻璃棒搅拌防止局部受热,液体飞溅.
解答 解:(1)步骤(1)是分离固液混合物,其操作为过滤,需要过滤装置,故选A;
步骤(2)分离互不相溶的液体混合物,需进行分液,要用到分液漏斗,故选D;
步骤(3)是从溶液中得到固体,操作为蒸发,需要蒸发皿,故选B;
步骤(4)是从有机化合物中,利用沸点不同采取蒸馏得到甲苯,需要蒸馏装置,故选C,
故答案为:A;D;B;C;
(2)装置中仪器①是蒸馏装置中的蒸馏烧瓶,仪器②是分液操作中的分液漏斗,①装置中是混合液体加热,要加入碎瓷片的目的是防止暴沸,
故答案为:蒸馏烧瓶;分液漏斗;防止暴沸;
(3)冷凝管中水流方向为逆流冷凝效果好,应从a口通入,故答案为:a;
(4)A.液溴和四氯化碳混溶不能分层,不能分液,故A错误;
B.乙醇和煤油混溶,不能分层,不能分液,故B错误;
C.苯和蒸馏水分层,可以用分液漏斗分液,故C正确;
D.氯化钠和水混溶不能分层,不能用分液漏斗分液,故D错误;
故选C;
(5)A装置是过滤,装置中玻璃棒是引流作用,B装置是蒸发浓缩结晶析出晶体,玻璃棒作用是:搅拌防止局部受热,液体飞溅,
故答案为:引流;搅拌防止局部受热,液体飞溅.
点评 本题以混合物的分离提纯,为高频考点,侧重于学生的分析能力和实验能力的考查,注意合成流程中物质的性质及分离方法是解答本题的关键,注重实验操作和分离方法的考查,题目难度不大.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:解答题
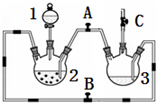 某化学兴趣小组拟用图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
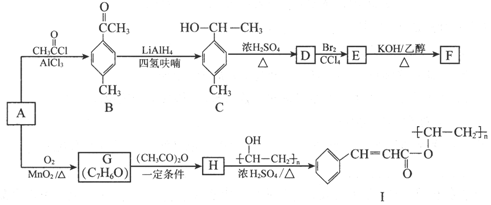
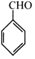
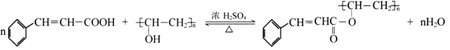
 (写出其中一种的结构简式).
(写出其中一种的结构简式). 的合成路线
的合成路线 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
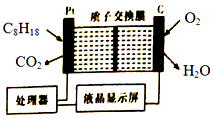 某油库为了强化安全管理,引进一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法不正确的是( )
某油库为了强化安全管理,引进一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法不正确的是( )| A. | 石墨电极作正极,发生还原反应 | |
| B. | H+由质子交换膜右侧向左侧迁移 | |
| C. | 每消耗标况下5.6LO2,电路中通过1 mol电子 | |
| D. | 铂电极的电极反应式:C8H18+16H20-5Oe-═8CO2↑+50H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液中可能大量存在:H+、Cl-、MnO${\;}_{4}^{-}$ | |
| B. | 室温下由水电离的 c(OH-)=1×10-12mol•L-1的溶液中能大量共存:K+、Na+、Cl-、HCO3- | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2 Fe3++2 Br2+6 Cl- | |
| D. | 稀硫酸和Ba(OH)2溶液反应:H++SO${\;}_{4}^{2-}$+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
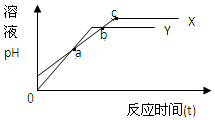 分别向等体积1mol/L盐酸和1mol/L醋酸溶液中加入等量的镁条,反应时间与溶液pH变化关系如图.下列说法中不正确的是( )
分别向等体积1mol/L盐酸和1mol/L醋酸溶液中加入等量的镁条,反应时间与溶液pH变化关系如图.下列说法中不正确的是( )| A. | Y代表盐酸与镁条的反应 | B. | a点时反应Y消耗镁条的量少 | ||
| C. | b点表示此时两溶液pH相等 | D. | c点表示此时反应结束 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com