
分析 (1)溶解固体时,为了加速溶解一般要用玻璃棒搅拌;根据配制溶液的体积选择容量瓶;
(2)Ba(OH)2溶液的浓度约为0.1mol•L-1,体积是25ml,由于酸式滴定管的容量是50ml,因此盐酸的浓度至少应该是0.1 mol•L-1,若盐酸的浓度过大,反应过快,不利于控制滴定终点;
(3)由反应方程式2HCl+Ba(OH)2=BaCl2+2H2O可知,n(氢氧化钡)=$\frac{1}{2}$n(HCl),根据消耗盐酸的物质的量计算氢氧化钡的物质的量和质量,再计算质量分数.
解答 解:(1)溶解固体时,为了加速溶解一般要用玻璃棒搅拌,则把固体置于烧杯中,加适量蒸馏水,然后搅拌溶解,将溶液转入容量瓶,实验要配制250mL溶液,应该选用250mL的容量瓶;
故答案为:搅拌溶解;250 mL容量瓶;
(2)Ba(OH)2溶液的浓度约为0.1mol•L-1,体积是25ml,由于酸式滴定管的容量是50ml,因此盐酸的浓度至少应该是0.1 mol•L-1的.若盐酸的浓度过大,反应过快,不利于控制滴定终点,所以选择0.1980 mol•L-1的盐酸最恰当;
故答案为:0.1980;
(3)由反应方程式2HCl+Ba(OH)2=BaCl2+2H2O可知,n(氢氧化钡)=$\frac{1}{2}$n(HCl),
消耗盐酸的物质的量为0.1980mol/L×V×10-3L=0.1980V×10-3mol
则25.00ml溶液中含有Ba(OH)2的物质的量是$\frac{1}{2}$×0.1980V×10-3mol,
所以w克试样中Ba(OH)2的质量是$\frac{1}{2}$×0.1980V×10-3×$\frac{250}{25}$×315g,
故Ba(OH)2•8H2O的质量分数=$\frac{250×0.1980×1{0}^{-3}×315×V}{2×25×w}$×100%.
故答案为:$\frac{250×0.1980×1{0}^{-3}×315×V}{2×25×w}$×100%.
点评 本题考查了物质含量的测定、溶液的配制、中和滴定实验,题目难度中等,注意把握中和滴定实验原理和实验操作,考查了学生的实验能力和数据处理能力.


科目:高中化学 来源: 题型:选择题

| A. | 分子中至少有12个碳原子处于同一平面上 | |
| B. | 分子中至少有10个碳原子处于同一平面上 | |
| C. | 分子中至少有11个碳原子处于同一平面上 | |
| D. | 该烃属于苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
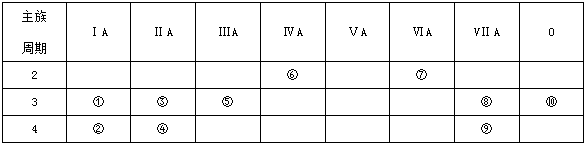
 ,用电子式表示⑦号元素氢化物的形成过程是
,用电子式表示⑦号元素氢化物的形成过程是 ,⑦号元素氢化物和元素②反应的离子方程式:2K+2H2O=2K++2OH-+H2↑.
,⑦号元素氢化物和元素②反应的离子方程式:2K+2H2O=2K++2OH-+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验或实验操作 | 现象 | 实验结论 | |
| A | 用大理石和盐酸反应制取CO2 气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
| B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 出现白色沉淀 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
| C | 将纯Zn片与纯Cu片用导线连接,浸入到稀硫酸溶液中 | Cu片表面产生大量气泡 | 金属性:Zn>Cu |
| D |  | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性: Cl2>Br2>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com