
分析 由①可知,白色沉淀为BaSO4,由②可知,红棕色沉淀为氢氧化铁,则一定含Fe3+,沉淀质量不减少,则一定不含Al3+,以此来解答.
解答 解:由①可知,白色沉淀为BaSO4,则一定含SO42-,可知不含Ba2+;
由②可知,红棕色沉淀为氢氧化铁,则一定含Fe3+,沉淀质量不减少,则一定不含Al3+,只观察沉淀,不生成气体,则不含NH4+,
综上所述,溶液中肯定存在的离子有Fe3+、SO42-;溶液中肯定不存在的离子有NH4+、Ba2+、Al3+;溶液中不能确定是否存在的离子有K+、Cl-、NO3-,
故答案为:Fe3+、SO42-;NH4+、Ba2+、Al3+;K+、Cl-、NO3-.
点评 本题考查常见离子的检验,为高频考点,把握发生的反应、现象与结论的关系为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
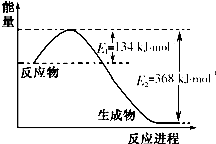 氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.| T/K | 398 | 498 |
| 平衡常数K | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用有少量蒸馏水的容量瓶配制溶液 | |
| B. | NaOH溶解后未冷却到室温即转移至容量瓶 | |
| C. | 移液后烧杯未用蒸馏水洗涤 | |
| D. | 定容时俯视液面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
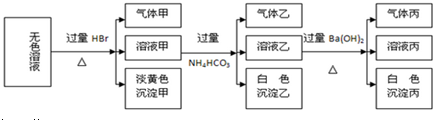
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | |||
| 2 | |||
| 3 | 检验CO2 | 澄清石灰水 | 溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
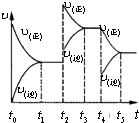 氨既是实验室中常用试剂,也是工业上重要原料.
氨既是实验室中常用试剂,也是工业上重要原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2 | B. | N2 | ||
| C. | NO2 | D. | 直径非常小的可吸入颗粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com