
在一定温度不同压强(P1<P2)下,可逆反应2X(g) 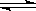 2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是( )
2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是( )
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
某无色溶液,其中可能存在的离子有:Na+、Ag+、Ba2+、Fe3+、Al3+、AlO2-、
S2-、SO32-、CO32-、SO42-,现取该溶液进行实验,实验结果如下:
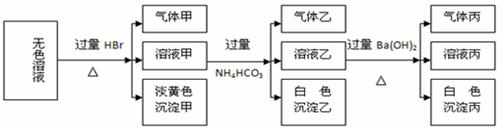
试回答下列问题:
(1)生成沉淀甲的离子方程式为: 。
(2)由溶液甲生成沉淀乙的离子方程式为 。
(3)已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表(表中每一行对应正确即可得分)
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | |||
| 2 | |||
| 3 | 检验CO2 | 澄清石灰水 | 溶液变浑浊 |
(4)综上所述,该溶液肯定存在的离子有: 。
(5)针对溶液中可能存在的离子,用实验证明是否存在的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是
A.σ键比π键的电子云重叠程度大,形成的共价键强
B.C=C双键的键能是C—C单键键能的2倍
C.s-s σ键与s-p σ键的电子云形状对称性相同
D.N2分子中有一个σ键,2个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构,下列关于X、Y、Z、W四种元素的描述,不正确的是
A. 离子半径:X+>Y2+>W2->Z- B.原子半径:X>Y>W>Z
C.原子序数:Y>X>Z>W D.原子最外层电子数:Z>W>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为长式周期表的一部分,其中的编号代表对应的元素。
| ① | ||||||||||||||||||
| ② | ③ | |||||||||||||||||
| ④ | ⑤ | ⑥ | ⑦ | |||||||||||||||
| ⑧ | ⑨ | ⑩ |
请回答下列问题:
(1)表中属于d区元素的是 (填元素符号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为 ;③和⑦形成的一种常见
溶剂的化学式为 ,其立体构型为________________。
(3)某元素原子的外围电子排布式为nsnnpn+1,该元素原子的最外电子层上孤电子对数为 ;该元素与
元素①所形成化合物的水溶液显 性(填“酸”或“碱”)。
(4)元素④的第一电离能 元素⑤(选填“>”、“=”、“<”)的第一电离能;元素⑥的电负性 元素⑦(选填“>”、“=”、“<”)的电负性。
(5)元素⑦和⑧形成的化合物的电子式为 。
(6)元素⑩的基态原子核外电子排布式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
请完成下面两个小题:
Ⅰ.(6分)反应m A+n B p C在某温度下达到平衡。
p C在某温度下达到平衡。
① 若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是______ _________。
② 若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向_____方向移动。
③ 如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为_____态。.
Ⅱ.(11分)在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:
2X(g)+Y(g)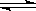 a Z(g)+W(g) ΔH=-Q kJ·mol-1(Q>0)
a Z(g)+W(g) ΔH=-Q kJ·mol-1(Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是____________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为____________(a为整数)。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?____(填“是或否”)其理由是__________________________________。
(4)维持温度不变,能引起c(X)/c(W)减小的操作有( )
A.加入X
B.加入Y
C.增大压强
D.充入He气
(5)X的转化率α=____________(用含Q、Q1的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:① CH3COOH与CH3COONa等物质的量混合配成的稀溶液,pH为4.7;
② 用等物质的量的HCN和NaCN配成的稀溶液中,C(CN-)<C(Na+)。
则下列说法不正确的是
A. CH3COONa的水解趋势大于CH3COOH的电离趋势
B. NaCN的水解趋势大于HCN的电离趋势
C. ②溶液中,c(H+)<c(OH-)
D. CH3COONa的存在抑制了CH3COOH的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)= 1.8×10-10,Ksp(AgY)= 1.0×10-12,Ksp(AgZ)= 8.7×10-17;
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(已被溶解的溶质的物质的量/1L溶液)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-) (填“增大”、“减小”或“不变”)。
(3)在25℃时,若取0.188g的AgY(相对分子质量188)固体放入100mL水中(忽略溶液体积的变化),则溶液中c(Y-)= mol/L
(4)①由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,并简述理由:
② 在上述(3)的体系中,能否实现AgY向AgX的转化?
请通过计算,简述能否实现转化的理由是:
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式
N2 + 3H2 = 2NH3 ΔH=—92.4 KJ/mol,则N≡N键的键能是 ( )
A.431 KJ/mol B.946 KJ/mol C.649 KJ/mol D.869 KJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com