
| A、Na2CO3 |
| B、MgCl2 |
| C、NH4Cl |
| D、NaCl |
 Mg2+(aq)+2OH-(aq),若促进氢氧化镁溶解,应使平衡向右移动,则有酸性越强,溶解度越大;
Mg2+(aq)+2OH-(aq),若促进氢氧化镁溶解,应使平衡向右移动,则有酸性越强,溶解度越大;

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
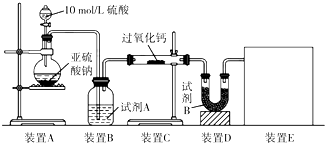 过氧化钙(CaO2)在日常生活和工农业生产中常用于种子消毒、药物制造、油脂漂白及鱼池增氧等.已知:过氧化钙与CO2反应有气体生成,而将SO2通入过氧化钙粉末中也有气体生成.有人提出CO2、SO2与过氧化钙的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作,通过测量气体的体积判断发生的化学反应,实验装置如图:
过氧化钙(CaO2)在日常生活和工农业生产中常用于种子消毒、药物制造、油脂漂白及鱼池增氧等.已知:过氧化钙与CO2反应有气体生成,而将SO2通入过氧化钙粉末中也有气体生成.有人提出CO2、SO2与过氧化钙的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作,通过测量气体的体积判断发生的化学反应,实验装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| △ |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| M | M的一种核素的质量数为63,中子数为34 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com