
【题目】某校化学兴趣小组的同学用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,回答下列问题:
(1)用分析天平准确称取该样品5.0g,全部溶于水配制成1000.0mL的溶液。用____(填一仪器名称)量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,待测。该中和滴定中可选用的指示剂是__________________________,(如有几种,可任填一种)滴定终点的现象是___________________________________________________________。
(2)用0.10mol/L的盐酸溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 20.00 | 24.01 |
2 | 20.00 | 23.99 |
3 | 20.00 | 22.10 |
计算样品中,NaOH的质量百分含量为__________________。
(3)若滴定前,滴定管尖端有气泡,滴定终了气泡消失,将使所测结果______(填“偏高”、“偏低”或“不变”,下同),若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果_______;
(4)下图为0.10mol/L 25 mL NaOH溶液中逐滴滴加0.10mol/L CH3COOH溶液过程中溶液pH的变化曲线,请回答:

①B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?______(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?________区间。(若正确,此问不答)。
②在D点时,溶液中c(CH3COO-)+c(CH3COOH)______2c(Na+)。(填“>”、“<”或“=”)
【答案】碱式滴定管 甲基橙或酚酞 溶液由黄色变为橙色(红色),且30s内不变为黄色或者溶液由粉红色变为无色,且30s内不变红 96% 偏高 偏低 否 AB =
【解析】
(1)NaOH会与酸式滴定管活塞中的二氧化硅反应生成具有黏性的硅酸钠,使活塞难以打开,故量取NaOH溶液用碱式滴定管;强酸与强碱完全反应时所得溶液呈中性,故酸碱指示剂可选用甲基橙或酚酞;若指示剂选甲基橙,终点现象为:溶液由黄色变为橙色(红色),且30s内不变为黄色;若指示剂选酚酞,终点现象为:溶液由粉红色变为无色,且30s内不变红。
(2)根据表格数据,第3次实验数据误差较大,不参与计算,两次实验消耗盐酸体积的平均值为![]() =24.00mL,根据n(NaOH)=n(HCl),则c(NaOH)×20.00mL=0.1mol/L×24.00mL,解得c(NaOH)=0.12mol/L,样品中NaOH的质量百分含量为=
=24.00mL,根据n(NaOH)=n(HCl),则c(NaOH)×20.00mL=0.1mol/L×24.00mL,解得c(NaOH)=0.12mol/L,样品中NaOH的质量百分含量为=![]() ×100%=96%。
×100%=96%。
(3)若滴定前,滴定管尖端有气泡,滴定终了气泡消失,导致消耗盐酸的体积偏大,将使所测结果偏高;若读酸式滴定管读数时,滴定前仰视读数,导致初读数据偏大,滴定后正确读数,消耗盐酸的体积偏小,则所测结果偏低。
(4)①醋酸是弱酸,NaOH是强碱,两者恰好反应生成强碱弱酸盐,溶液显碱性,而B点溶液显中性,不是NaOH与CH3COOH恰好完全反应的点;则恰好反应区间在AB。
②D点是同浓度NaOH 25mL与50mL CH3COOH混合,得到含等物质的量的CH3COOH 与CH3COONa 的混合溶液,根据物料守恒可得溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+)。


科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
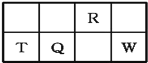
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.T、Q、W最高价氧化物对应的水化物均能与R的最高价氧化物对应的水化物发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的晶胞结构如图所示。下列说法错误的是( )
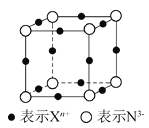
A.X元素的原子序数是19
B.该晶体中阳离子与阴离子个数比为3∶1
C.Xn+中n=1
D.晶体中每个Xn+周围有2个等距离且最近的N3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构是用碳原子取代氮化钛晶胞(结构如图Ⅰ)顶点的氮原子,这种碳氮化钛化合物的化学式为___。

(2)图Ⅱ是由Q、Cu、O三种元素组成的一种高温超导体的晶胞结构,其中Cu为+2价,O为-2价,则Q的化合价为___价。
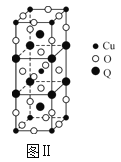
(3)一种新型阳极材料LaCrO3的晶胞如图Ⅲ所示,已知距离每个Cr原子最近的原子有6个,则图Ⅲ中___(填字母)原子代表的是Cr原子。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2可用作漂白剂和呼吸面具中的供氧剂
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液。此时再向试管中加入少量MnO2粉末,又有气泡产生,该气体能使带火星的木条复燃。
①写出Na2O2在呼吸面具中作供氧剂的两个化学反应方程式__________,__________;
②滴入酚酞溶液后看到的现象是________;
③已知MnO2作为催化剂,则加入MnO2反应的化学方程式为_____;
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下:
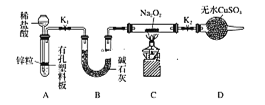
步骤1:按如图组装仪器(图中夹持仪器省略),装入药品。
步骤2:打开K1、K2,产生的气体流经装有Na2O2的硬质玻璃管,一段时间后没有任何现象。
步骤3:开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
(提示:B装置的作用是吸收A装置中挥发的HCl气体和水蒸气。)
①步骤1组装好仪器之后,装入药品之前,应________。
②A装置中添加稀盐酸的仪器名称是_____,A装置中发生反应的离子方程式为______。
③步骤3在点燃C处酒精灯前必须进行的操作是________;④你得到的结论是______ (若能反应请用化学方程式表示);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的某溶液X中含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO42-、SO32-、Cl-、NO3-中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如图。下列有关推断不正确的是( )
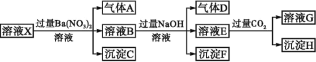
A.溶液X中一定含有NH4+、Al3+、H+、Fe2+、SO42-
B.根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl-
C.沉淀H为Al(OH)3、BaCO3的混合物
D.若溶液X为100 mL,产生的气体A为44.8 mL(标准状况),则X中c(Fe2+)=0.06 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同,且SO42-物质的量浓度为6 mol/L,则此溶液最多溶解铁粉的质量为( )
A.11.2 gB.16.8 gC.19.6 gD.22.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以天然气为原料合成氨是现代合成氨工业发展的方向与趋势
(一)天然气与氮气为原料,以固态质子交换膜为电解质,在低温常压下通过电解原理制备氨气如图所示:

写出在阴极表面发生的电极反应式:_____________。
(二)天然气为原料合成氨技术简易流程如下:
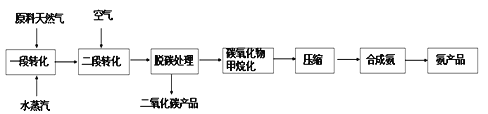
一段转化主要发生的反应如下:
①CH4(g) +H2O(g) ![]() CO(g)+3H2(g) ΔH1 = 206 kJ·molˉ1
CO(g)+3H2(g) ΔH1 = 206 kJ·molˉ1
②CO(g) + H2O(g) ![]() CO2(g) + H2(g) ΔH2 = -41 kJ·molˉ1
CO2(g) + H2(g) ΔH2 = -41 kJ·molˉ1
二段转化主要发生的反应如下:
③2CH4(g)+ O2(g) ![]() 2CO(g)+4H2(g) ΔH3 = -71.2 kJ·molˉ1
2CO(g)+4H2(g) ΔH3 = -71.2 kJ·molˉ1
④2CO(g) + O2(g) ![]() 2CO2(g) ΔH4 = -282 kJ·molˉ1
2CO2(g) ΔH4 = -282 kJ·molˉ1
(1)已知CO中不含C=O,H-H的键能为436 kJ·molˉ1,H-O的键能为463 kJ·molˉ1,C-H的键能为414 kJ·molˉ1,试计算C=O的键能_________。
(2)实验室模拟一段转化过程,在800oC下,向体积为1L的恒容密闭反应器中,充入1mol的CH4与1mol的H2O,达到平衡时CH4的转化率为40%,n(H2)为1.4mol,请计算反应②的平衡常数_________。
(3)下列说法正确的是_________。
A.合成氨过程实际选择的温度约为700℃,温度过高或过低都会降低氨气平衡产率
B.上述工业流程中压缩既能提高反应速率又能提高合成氨的产率
C.二段转化释放的热量可为一段转化提供热源,实现能量充分利用
D.二段转化过程中,需严格控制空气的进气量,否则会破坏合成气中的氢氮比
(4)已知催化合成氨中催化剂的活性与催化剂的负载量、催化剂的比表面积和催化反应温度等因素有关,如图所示:

①实验表明相同温度下,负载量5%催化剂活性最好,分析负载量9%与负载量1%时,催化剂活性均下降的可能原因是________。
②在上图中用虚线作出负载量为3%的催化剂活性变化曲线_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com