
| A�� | ʵ����в���������Ϊ���������ɵ�ԭ��Һ��c��NH4+��=0.1 mol•L-1 | |
| B�� | ʵ����еij�����һ����BaSO4��������Mg��OH��2 | |
| C�� | ��Ҫ�ж�ԭ��Һ���Ƿ���Cl-�������������ʵ����֤ | |
| D�� | ԭ��Һ��һ����K+����c��K+����0.4 mol•L-1 |
���� �ٵ�һ�ݼӹ���NaOH��Һ����ȣ��ռ���0.02mol���壬��Ϊ������һ������NH4+�����ʵ���Ϊ0.02mol��Ũ��Ϊ��$\frac{0.02mol}{0.05L}$=0.4mol/L���������ɣ���һ��������Fe3+��Mg2+��
�������Һ��ͨ�����CO2�����ɰ�ɫ��������Ϊ������������ԭ��Һ��һ����Al3+��һ��������̼������ӣ������Ӻ������������Ʒ�Ӧ����ƫ��������Һ����Һ��ͨ�����CO2�����ɰ�ɫ��������Ϊ���������������������������ˡ�ϴ�ӡ����պõ�1.02g���弴Ϊ��������������Ԫ���غ㣬�õ������ӵ����ʵ�����$\frac{1.02g}{102g/mol}$��2=0.02mol��Ũ��Ϊ��$\frac{0.02mol}{0.05L}$=0.4mol/L��
�۵ڶ��ݼ�����BaCl2��Һ�����ɰ�ɫ��������һ��������������ӣ��ޱ����ӣ���������������ϴ�ӡ�����õ�11.65g���弴���ᱵ��������11.65g�����ʵ���Ϊ��$\frac{11.65g}{233g/mol}$=0.05mol������Ԫ���غ㣬������������ӵ����ʵ�����0.05mol��Ũ��Ϊ��$\frac{0.05mol}{0.05L}$=1mol/L��
���Ͽ�֪��һ�����е������ǣ�NH4+��Al3+��SO42-����Ũ�ȷֱ��ǣ�0.4mol/L��0.4mol/L��1mol/L��һ������Fe3+��Mg2+��Ba2+��SO42������ȷ���Ƿ���������ӣ��Դ˽����⣮
��� �⣺�ٵ�һ�ݼӹ���NaOH��Һ����ȣ��ռ���0.02mol���壬��Ϊ������һ������NH4+�����ʵ���Ϊ0.02mol��Ũ��Ϊ��$\frac{0.02mol}{0.05L}$=0.4mol/L���������ɣ���һ��������Fe3+��Mg2+��
�������Һ��ͨ�����CO2�����ɰ�ɫ��������Ϊ������������ԭ��Һ��һ����Al3+��һ��������̼������ӣ������Ӻ������������Ʒ�Ӧ����ƫ��������Һ����Һ��ͨ�����CO2�����ɰ�ɫ��������Ϊ���������������������������ˡ�ϴ�ӡ����պõ�1.02g���弴Ϊ��������������Ԫ���غ㣬�õ������ӵ����ʵ�����$\frac{1.02g}{102g/mol}$��2=0.02mol��Ũ��Ϊ��$\frac{0.02mol}{0.05L}$=0.4mol/L��
�۵ڶ��ݼ�����BaCl2��Һ�����ɰ�ɫ��������һ��������������ӣ��ޱ����ӣ���������������ϴ�ӡ�����õ�11.65g���弴���ᱵ��������11.65g�����ʵ���Ϊ��$\frac{11.65g}{233g/mol}$=0.05mol������Ԫ���غ㣬������������ӵ����ʵ�����0.05mol��Ũ��Ϊ��$\frac{0.05mol}{0.05L}$=1mol/L��
���Ͽ�֪��һ�����е������ǣ�NH4+��Al3+��SO42-����Ũ�ȷֱ��ǣ�0.4mol/L��0.4mol/L��1mol/L��һ������Fe3+��Mg2+��Ba2+��SO42������ȷ���Ƿ���������ӣ�
A���������Ϸ�����֪��c ��NH4+��=0.4 mol•L-1����A����
B���������Ϸ�����֪�����еİ�ɫ������һ����BaSO4������Һ������þ���ӣ���û������������þ����B����
C�������Ϸ�����֪������ȷ�����������ӣ���C����
D���κ���Һ�ж����ڵ���غ㣬NH4+��Al3+��SO42-����Ũ�ȷֱ��ǣ�0.4mol/L��0.4mol/L��1mol/L������֪��NH4+��Al3+�����������С��SO42-��������������ݵ���غ㣬��һ����K+���ڣ����������Ӵ��ڣ���0.4��1+0.4��3+c��K+����1=1��2�����c��K+��=0.4mol/L����D��ȷ��
��ѡD��
���� ���⿼�����ӵļ��飬Ϊ��Ƶ���㣬������ѧ���ķ��������������Ŀ��飬��Ŀ���ö���ʵ��Ͷ�������������ϵ�ģʽ�������˽����Ѷȣ�ͬʱ�漰���ӹ��桢���ӷ�Ӧ�ȶ��ǽ�����ע�����Ϣ��������K+��ȷ���׳���ʧ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
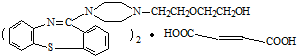 �����ĺϳ�·�����£�
�����ĺϳ�·�����£�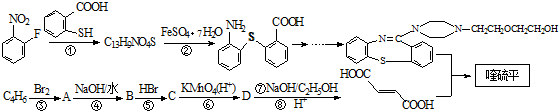
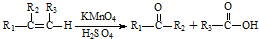
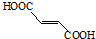 ���еĹ���������Ϊ̼̼˫�����Ȼ���
���еĹ���������Ϊ̼̼˫�����Ȼ���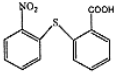 ��
��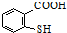 ��һ�������·������۷�Ӧ�Ļ�ѧ����ʽΪ
��һ�������·������۷�Ӧ�Ļ�ѧ����ʽΪ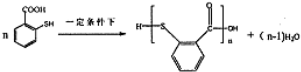 ��
��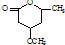 ��һ����Ҫ���л����������ƺ�����������ɴ�
��һ����Ҫ���л����������ƺ�����������ɴ�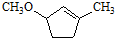 ��
��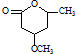 �ĺϳ�·������ͼ�����Լ����ã���
�ĺϳ�·������ͼ�����Լ����ã����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ɫ��Һ��Cu2+��H+��Cl-��HSO3- | |
| B�� | ��ʹpH��ֽ�ʺ�ɫ����Һ��Na+��Fe2+��Cl-��NO3- | |
| C�� | ��ˮ�������c��H+��=1��10-12mol/L����Һ�У�K+��Fe3+��Cl-��NO3- | |
| D�� | $\frac{{K}_{w}}{c��{H}^{+}��}$=0.1 mol/L����Һ��Na+��K+��SiO32-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
��| Ka1 | Ka2 | |
| H2SO3 | 1.3��10-2 | 6.3��10-8 |
| H2CO3 | 4.2��10-7 | 5.6��10-11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaB��Һ��pH=8��c��Na+��-c��B-��=9.9��10-7 mol/L | |
| B�� | Na2CO3��Һ�У�2c��Na+��=c��CO${\;}_{3}^{2-}$��+c��HCO${\;}_{3}^{-}$��+c��H2CO3�� | |
| C�� | pH��ȵĢ�NH4NO3���ڣ�NH4��2SO4����NH4HSO4������Һ�У�c��NH${\;}_{4}^{+}$����С˳��Ϊ���٣��ڣ��� | |
| D�� | 10 mL pH=12������������Һ�м���pH=2��HA��Һ��pH�պõ���7����������Һ���V���ܣ�=20 mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ͼ��ijѧУʵ���Ҵӻ�ѧ�Լ��̵���ص������Լ���ǩ�ϵIJ������ݣ�
��ͼ��ijѧУʵ���Ҵӻ�ѧ�Լ��̵���ص������Լ���ǩ�ϵIJ������ݣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
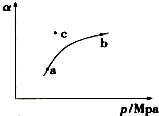 ���������ձ�����һ����Ҫ���ָ����SO2�ĺ����������ѧ֪ʶ�ش��������⣮��ҵ������Ĺ����У�SO2��������ԭ��Ϊ��
���������ձ�����һ����Ҫ���ָ����SO2�ĺ����������ѧ֪ʶ�ش��������⣮��ҵ������Ĺ����У�SO2��������ԭ��Ϊ��| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | ||
| SO2 | O2 | SO2 | O2 | ||
| 1 | T1 | 4 | 2 | x | 0.8 |
| 2 | T2 | 4 | 2 | 0.4 | y |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 5NH4NO3$\frac{\underline{\;\;��\;\;}}{\;}$2HNO3+4N2��+9H2O�ķ�Ӧ�У�����28 g N2��ת�Ƶĵ�����ĿΪ3.75NA | |
| B�� | �����£�0.2 mol Fe������ˮ������Ӧ�����ɵ�H2������ĿΪ0.3NA | |
| C�� | ����ȼ�ϵ����������22.4 L����״��������ʱ����·��ͨ���ĵ�����ĿΪ4NA | |
| D�� | �����£�1 L pH=13��NaOH��Һ�У���ˮ�����OH-��ĿΪ10-13NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com