
| A、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C、加入硝酸银溶液有白色沉淀产生,一定有Cl- |
| D、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |


科目:高中化学 来源: 题型:
| A、合成氨工业常采用合适的催化剂 |
| B、配制FeCl2溶液时在溶液中加入少量铁粉 |
| C、NO2与N2O4的平衡体系加压,气体颜色会变深 |
| D、向重铬酸钾溶液中滴加几滴氢氧化钠溶液后,溶液由橙色变为黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸和食醋既是化合物又是酸 |
| B、含氧酸酸性越强与铁片反应放出氢气的速率越快 |
| C、含4%硅的硅钢具有很好的导磁性,主要用作变压器铁芯 |
| D、蛋白质、淀粉、纤维素、油脂等都能在人体内水解并提供能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道上电子全充满或半充满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
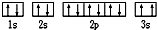 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作与现象 | 实验结论 | 判断理由 | |
| 步骤一 | 加入过量NaOH溶液,得到蓝色沉淀; | 肯定有Cu2+、肯定无 | 肯定无该离子的理由 |
| 步骤二 | 将蓝色沉淀过滤、洗涤、灼烧得到24.0g固体; | Cu2+物质的量浓度为 | Cu元素守恒 |
| 步骤三 | 向上述滤液中加足量Ba(NO3)2溶液,得到46.6g不溶于稀硝酸的沉淀. | 肯定有Cl-、 | 肯定有Cl-的理由 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| +2 |
| Xe |
| -2 |
| F |
| +1 |
| X |
| -1 |
| F |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① ② … | 若银镜消失,假设2成立. 若银镜不消失,假设2不成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com