
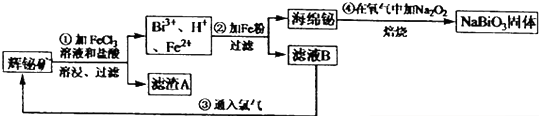
分析 辉铋矿(主要成分是Bi2S3.还含少量Bi203,SiO2等杂质)制备铋酸钠,辉铋矿加入氯化铁溶液和盐酸溶解后过滤,氯化铁氧化硫离子为硫单质,盐酸是防止FeCl3及BiCl3水解生成不溶性沉淀,得到滤渣为SiO2和S,滤液中含有Bi3+,H+,Fe2+,滤液中加入铁粉过滤得到海绵铋,和滤液B主要是氯化亚铁,通入氯气后生成氯化铁,然后循环使用,海绵铋在氧气中加入过氧化钠发生氧化还原反应生成NaBiO3;
(1)提高溶浸工序中原料的浸出率,可以结合影响化学反应速率的因素分析;
(2)加入过量浓盐酸的目的是防止FeCl3及BiCl3水解生成不溶性沉淀,上述分析可知滤渣为二氧化硅和氯化铁氧化生成的硫单质;
(3)铋酸钠可在酸性介质中将Mn2+氧化为Mn04-,NaBi03被还原为Bi3+,依据电荷守恒和原子守恒书写反应的离子方程式:
(4)配制溶液步骤和过程分析需要的玻璃仪器,烧杯中溶解后,转移到容量瓶,加水至刻度定容;
(5)依据化学反应的定量关系计算,5NaBiO3~2MnO4 -~10Fe2+,得到NaBiO3物质的量,得到质量计算质量分数.
解答 解:辉铋矿(主要成分是Bi2S3.还含少量Bi203,SiO2等杂质)制备铋酸钠,辉铋矿加入氯化铁溶液和盐酸溶解后过滤,氯化铁氧化硫离子为硫单质,盐酸是防止FeCl3及BiCl3水解生成不溶性沉淀,得到滤渣为SiO2和S,滤液中含有Bi3+,H+,Fe2+,滤液中加入铁粉过滤得到海绵铋,和滤液B主要是氯化亚铁,通入氯气后生成氯化铁,然后循环使用,海绵铋在氧气中加入过氧化钠发生氧化还原反应生成NaBiO3;
(1)a.加入足量的蒸馏水不能溶解矿石中的物质,不能提高浸出率,故a错误;
b.拢拌加快物质溶解,能提高浸出率,故b正确;
e.粉碎矿石增大接触面积,提高反应速率,故c正确;
d.升离温度提高反应速率,可以提高溶浸工序中原料的浸出率,故d正确,
故答案为:bcd;
(2)加入过量浓盐酸的目的是防止FeCl3及BiCl3水解生成不溶性沉淀,上述分析可知滤渣为二氧化硅和氯化铁氧化生成的硫单质,
故答案为:防止FeCl3及BiCl3水解生成不溶性沉淀,提高原料的浸出率;SiO2、S;
(3)铋酸钠可在酸性介质中将Mn2+氧化为Mn04-,NaBi03被还原为Bi3+,由电荷守恒和原子守恒可知反应的离子方程式为5NaBiO3+2Mn2++14H+=2MnO4-+5Na++5Bi3++7H2O,
故答案为:5NaBiO3+2Mn2++14H+=2MnO4-+5Na++5Bi3++7H2O;
(4)配制溶液步骤和过程分析需要的玻璃仪器,所需要的玻瑞仪器除烧杯、量筒、玻璃棒外,还需要250mL容量瓶、胶头滴管,配制2.0mo1•L-1FeSO4溶液定容时具体的操作步骤为,硫酸亚铁在烧杯中溶解后,转移到容量瓶,加水至刻度定容,具体步骤为:沿着玻璃棒向容量瓶中加入蒸馏水至离刻度线1~2cm处,再改用胶头滴管滴加蒸馏水至溶液凹液面与刻度线相切,
故答案为:沿着玻璃棒向容量瓶中加入蒸馏水至离刻度线1~2cm处,再改用胶头滴管滴加蒸馏水至溶液凹液面与刻度线相切;
(5)由5NaBiO3+2Mn2++14H+=2MnO4-+5Na++5Bi3++7H2O、MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O可知,
5NaBiO3~2MnO4 -~10Fe2+,
5 10
n(NaBiO3) 2.0mo1•L-1×0.0310L
n(NaBiO3)=0.031mol
得到质量计算质量分数=$\frac{0.031mol×280g/mol}{10.0g}$×100%=86.8%,
故答案为:86.8%.
点评 本题考查了物质分离提纯的方法和过程分析判断,实验基本操作,溶液配制方法的分析应用,注意物质性质的理解应用,掌握基础是关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| X | Y | ||
| M | Z |
| A. | 简单氢化物稳定性:X>Z | B. | 简单离子半径:Y<M | ||
| C. | 最高价氧化物水化物的酸性:X<Z | D. | 得电子能力:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;I的分子式是C8H6O3.
;I的分子式是C8H6O3.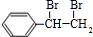 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$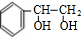 +2NaBr;反应类型属于水解反应.
+2NaBr;反应类型属于水解反应.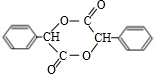 .
. 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?H3O++CO32- | B. | HS-+H2O?H2S+OH- | ||
| C. | H2PO4-+H2O?HPO42-+H3O+ | D. | HCO3-+OH-?H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24L | B. | 1.12L | C. | 0.672L | D. | 0.448L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.6g | B. | 6.4g | C. | 3.2g | D. | 1.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
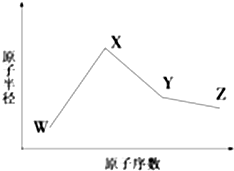 W、X、Y、Z、M、N是六种常见的短周期元素,其中W、X、Y、Z原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.M的原子序数比Y小1,N元素最高化合价是最低化合价绝对值的3倍.
W、X、Y、Z、M、N是六种常见的短周期元素,其中W、X、Y、Z原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.M的原子序数比Y小1,N元素最高化合价是最低化合价绝对值的3倍.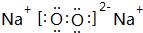 ,
,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com