
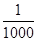 的氰酸盐(含CNO-)。
的氰酸盐(含CNO-)。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源:不详 题型:填空题
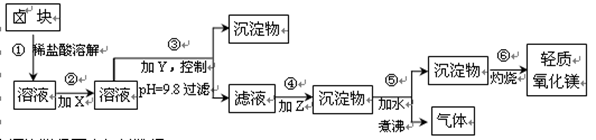
| 表1: 生成氢氧化物沉淀的pH | 表2: 原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | KCl | K2SO4 | ZnCl2 | ZnSO4 |
| 甲 | 0.3 mol·L-1 | 0.2 mol·L-1 | 0 | 0.1 mol·L-1 |
| 乙 | 0.1 mol·L-1 | 0.3 mol·L-1 | 0.1 mol·L-1 | 0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.用铜做电极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
| B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ |
| C.明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+ |
| D.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 序号 | 实验内容 | 实验结果 |
| 1 | 加过量盐酸 | 无气体产生 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体1.12 L(已折算成标准状况下的体积),并有红褐色沉淀生成,将沉淀过滤洗涤、干燥、灼烧,称重得1.60 g固体。 |
| 3 | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量 | 第一次称量读数为2.33 g |
| 阴离子符号 | 物质的量浓度(mol·L-1) |
| | |
| | |
| | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K+、Cu2+、SO42-、NO3- | B.Na+、Ba2+、Br-、SO42- |
| C.NH4+、Fe3+、Cl-、SCN- | D.K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.少量的CO2通人氨水中:CO2+NH3·H2O=NH4++HCO3- |
B.Na2O2溶于水中:2Na2O2+2H2O=4Na++4OH-+O2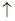 |
| C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ |
D.用惰性电极电解熔融氯化钠:2C1-+2H2O Cl2 Cl2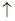 +H2 +H2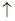 +2OH- +2OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu2+、Fe3+、H+ |
| B.在含I-、SO32-、Br-的溶液中不断通入氯气:I-、Br-、SO32- |
| C.在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO32- |
| D.在含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液:H+、NH4+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
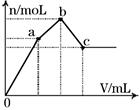
| A.NH4Al(SO4)2 | B.KAl(SO4)2 |
| C.Al2(SO4)3 | D.Na2SO4与NaAlO2组成的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com