
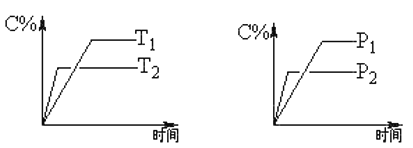
【题目】可逆反应:mA(固)+nB(气)![]() eC(气)+fD(气),反应过程中,当其他条件不变时,C的体积分数(C%)与温度T和压强P的关系如图。下列叙述正确的是
eC(气)+fD(气),反应过程中,当其他条件不变时,C的体积分数(C%)与温度T和压强P的关系如图。下列叙述正确的是
A.达到平衡后,加入催化剂C%增大
B.达到平衡后,若升温平衡向左移
C.m+n<e+f
D.达平衡后,若降压平衡向左移动
【答案】B
【解析】
可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短,由图象(1)可知T2>T1,温度越高,平衡时C的体积分数φ(C)越小,故此反应的正反应为放热反应;当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短.由图(2)可知p2>p1,压强越大,平衡时C的体积分数φ(C)越小,可知正反应为气体物质的量增大的反应,即n<e+f,据此结合外界条件对化学平衡的影响分析解答。
A.催化剂只改变化学反应速率,对平衡移动没有影响,C的质量分数不变,故A错误;
B.由上述分析可知,可逆反应mA(固)+nB(气)![]() eC(气)+fD(气)正反应为放热反应,升高温度平衡向吸热方向移动,即向逆反应方向移动,故B正确;
eC(气)+fD(气)正反应为放热反应,升高温度平衡向吸热方向移动,即向逆反应方向移动,故B正确;
C.由上述分析可知,可逆反应mA(固)+nB(气)![]() eC(气)+fD(气)正反应为气体物质的量增大的反应,即n<e+f,故C错误;
eC(气)+fD(气)正反应为气体物质的量增大的反应,即n<e+f,故C错误;
D.达平衡后,若降压平衡向气体体积增大的方向移动,则平衡向右移动,故D错误;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2,下列说法不正确的是

A.在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由b点到c点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列可以证明![]() 已达平衡状态的是( )
已达平衡状态的是( )
①单位时间内生成n mol H2的同时生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③温度和体积一定时,混合气体密度不再变化
④v(H2)=v(I2)=0.5v
⑤c(HI): c(H2): c(I2)=2:1:1
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧温度和压强一定时,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
A.②③④⑤⑥B.②⑥⑦8⑨C.①②⑥④⑧D.②⑥⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,其中P为电解质溶液。由此判断M、N、P所代表的物质可能是( )
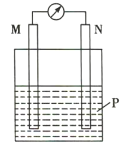
选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 锌 | 稀硫酸 |
C | 银 | 锌 | AgNO3溶液 |
D | 铜 | 铁 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时在2 L的密闭容器中X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,反应温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是
 A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·(L·min)-1
A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·(L·min)-1
B.容器中发生的反应可表示为3X(g)+Y(g) ![]() 2Z(g)
2Z(g)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一个容积为1L的密闭容器中,充入1molH2(g)和1mol I2(g),发生反应H2(g)+I2(g)![]() 2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,该温度下,在另一个容积为2L的密闭容器中充入1molHI(g)发生反应HI(g)
2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,该温度下,在另一个容积为2L的密闭容器中充入1molHI(g)发生反应HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g),则下列判断正确的是( )
I2(g),则下列判断正确的是( )
A.后一反应的平衡常数为1
B.后一反应的平衡常数为0.5
C.后一反应达到平衡时,H2的平衡浓度为0.25 mol·L-1
D.后一反应达到平衡时,HI(g)的平衡浓度0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
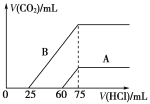
(1)原NaOH溶液的物质的量浓度为____________mol/L。
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是____________,其物质的量之比为__________。
(3)曲线B表明,所得溶液加盐酸后产生CO2气体体积(标况)的最大值为 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根皮素J(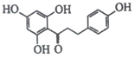 )是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
)是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
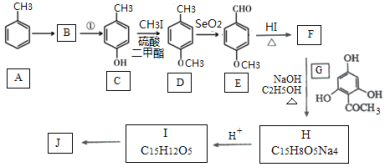
已知:
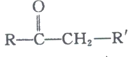 +R’’CHO
+R’’CHO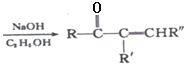 +H2O
+H2O
回答下列问题:
(1)C的化学名称是___________.E中的官能团的名称为_______________.
(2)B为溴代烃,请写出A→B的反应条件___________.
(3)写出由C生成D和由D生成E的反应类型___________、___________.
(4)F→H的化学方程式为______________________.
(5)M是E的同分异构体,同时符合下列条件的M的结构有___________种(不考虑立体异构)
①能与FeCl3溶液发生显色反应 ②能发生银镜反应
(6)设计以丙烯和1,3-丙二醛为起始原料制备![]() 的合成路线_______(无机试剂任选).
的合成路线_______(无机试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见的某反应化学方程式为X +Y→M+N +H2O(未配平,反应条件已略去),下列叙述错误的是
A. 若X、Y的物质的量之比为1:4,且N是黄绿色气体,则该反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B. 若M、N为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪色,橙色褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-
C. 若X是铁,Y是稀硝酸(过量),则X与Y反应的离子方程式为Fe+4H++NO3- = Fe3+ +NO↑+2H2O
D. 当N为氯碱工业的主要原料,M是造成温室效应的主要气体,则上述反应的离子方程式一定为:CO32-+2H+=CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com