
| A. | NaHCO3═Na++H++CO32- | B. | NaHSO4═Na++H++SO42- | ||
| C. | MgCl2═Mg2++2Cl- | D. | Ca(OH)2═Ca2++2OH- |
分析 A.碳酸氢钠为强电解质,完全电离,碳酸氢根离子为弱酸的酸式根离子不能拆;
B.NaHSO4是强酸强碱酸式盐,属强电解质,溶液中完全电离,电离出Na+、H+、SO42-离子;
C.氯化镁属于盐,为强电解质,完全电离出镁离子和氯离子;
D.氢氧化钙为二元强碱,完全电离出钙离子、氢氧根离子.
解答 解:A.碳酸氢钠在水中电离出钠离子和碳酸氢根离子,电离方程式为NaHCO3═Na++HCO3-,故A错误;
B.硫酸氢钠属于二元强酸硫酸的酸式盐,能完全电离:NaHSO4=Na++H++SO42-,故B正确;
C.氯化镁属于盐,为强电解质,完全电离:MgCl2═Mg2++2Cl-,故C正确;
D.氢氧化钙为二元强碱,完全电离:Ca(OH)2═Ca2++2OH-,故D正确;
故选A.
点评 本题考查电解质的电离方程式书写,题目难度不大,掌握电离方程式书写规则并能灵活运用是正确解答此类题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 氯化硼液态时能导电而固态时不导电 | |
| B. | 硼原子以sp杂化 | |
| C. | 氯化硼晶体为分子晶体 | |
| D. | 氯化硼是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
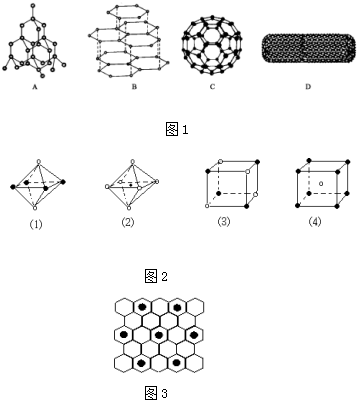
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠具有银白色金属光泽,在空气中易变质,生成过氧化钠 | |
| B. | 钠应保存在煤油中 | |
| C. | 钠的化学性质很活泼,在自然界不能以游离态存在 | |
| D. | 钠和钾的合金在室温呈液态,可做原子反应堆的导热剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 离子方程式 | 单质氧化性 |
| 向NaBr溶液中滴入氯水,一段时间后再加入CCl4 | 静置后,液体分层,上层接近无色,下层橙红色 | 2Br-+Cl2=2 Cl-+Br2 | Cl2>Br2 |
| 向KI溶液中滴入氯水,一段时间后再加入CCl4 | 静置后,液体分层,上层接近无色,下层紫色 | 2I-+Cl2=2 Cl-+I2 | Cl2>I2 |
| 向KI溶液中滴入溴水,一段时间后再加入CCl4 | 静置后,液体分层,上层接近无色,下层紫色 | 2I-+Br2=2 Br-+I2 | Br2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
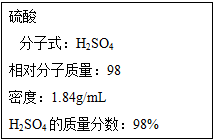 如图为实验室某浓硫酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com