
(1)一定条件下,发生反应CO(g)+H2O(g)  CO2(g)+H2(g),向2 L密闭容器中通入2 mol CO(g)、1 mol H2O(g),2 min 后反应达到平衡时,测得CO的物质的量为1.6 mol,用H2O(g)表示该反应速率为 ,此温度下,该反应的平衡常数为 。若往容器中再加入2 mol CO(g),则重新
CO2(g)+H2(g),向2 L密闭容器中通入2 mol CO(g)、1 mol H2O(g),2 min 后反应达到平衡时,测得CO的物质的量为1.6 mol,用H2O(g)表示该反应速率为 ,此温度下,该反应的平衡常数为 。若往容器中再加入2 mol CO(g),则重新 达到平衡时的CO总转化率
达到平衡时的CO总转化率
20%(填“>”、“<”或“=”)。
(2)在一密闭容器中发生反应2NO2 2NO+O2 ΔH>0,反应
2NO+O2 ΔH>0,反应 过程中NO2的浓度随时间变化的情况如下图所示:
过程中NO2的浓度随时间变化的情况如下图所示:
若曲线A、B分别表示的是该反应在某不同条件 下的反应情况,则曲线B此条件可能是________(填“增大压强”、“减小压强”、“升高温度”、“降低温度”或“使
下的反应情况,则曲线B此条件可能是________(填“增大压强”、“减小压强”、“升高温度”、“降低温度”或“使 用催化剂”)。
用催化剂”)。
(3)一定温度下,在密闭容器中N2O5可发生下列反应:
①2N2O5(g)  4NO2(g)+O2(g) ②2NO2(g)
4NO2(g)+O2(g) ②2NO2(g)  2NO(g)+O2(g)
2NO(g)+O2(g)
若达平衡时,c(NO2)=0.6 mol·L-1,c(O2)=1.3 mol·L-1,则反应②中NO2的转化率为________。
科目:高中化学 来源: 题型:
霉酚酸酯(结构如下图)是器官移植中抑制细胞增殖最常用的药物。下列说法正确的是

A. 霉酚酸酯能溶于水
B. 霉酚酸酯能与浓溴水发生取代反应
C. 1 mol霉酚酸酯能与含4 mol NaOH的水溶液完全反应
D. 霉酚酸酯既可以催化加氢,又可以使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置进行相应实验,能达到实验目的的是
| 选项 | A | B | C | D |
| 装置 |
|
|
|
|
| 目的 | 除去Cl2中含有的少量HCl | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | 制取少量纯净的CO2气体 | 分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,向容积为2 L的密闭容器中充入一定量A和足量B,发生反应如下:2A(g)+B(s)2C(g),测得相关数据如下,分析可知下列说法不正确的是
| 实验Ⅰ | 实验Ⅱ | 实验Ⅲ | |
| 反应温度/℃ | 800 | 800 | 850 |
| c(A)起始/mol·L-1 | 1 | 2 | 1 |
| c(A)平衡/mol·L-1 | 0.5 | 1 | 0.85 |
| 放出的热量/kJ | a | b | c |
A.实验Ⅲ的化学平衡常数K<1 B.实验放出的热量关系为b=2a
C.实验Ⅲ在30 min达到平 衡,30 min内A的速率:v(A)=0.002 5 mol·L-1·min-1
衡,30 min内A的速率:v(A)=0.002 5 mol·L-1·min-1
D.当容器内气体密度不随时间而变化时上述反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)  2C(g),达到平衡后,在不同的时间段,下列说法中正确的是
2C(g),达到平衡后,在不同的时间段,下列说法中正确的是
A.30~40 min间该反应使用了催化剂
B.化学方程式中的x=1,正反应为吸热反应
C.30 min时降低温度,40 min时升高温度
D.8 min前A的平均反应速率为0.08 mol·L-1·min-1

查看答案和解析>>
科目:高中化学 来源: 题型:
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s) + 3C(石墨) = 2Fe(s) + 3CO(g) △H 1 = +489.0 kJ·mol-1
C(石墨) +CO2(g) = 2CO(g) △H2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图10所示,则该反应的ΔH 0(填“>”、“<”或“=”)。
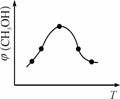
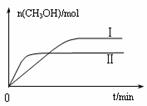
图10 图11
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图11所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 。当氨碳比 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 。
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为  。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
己烯雌酚是一种激素类药物,其结构简式如下图所示。下列有关叙述中不正确的是
 A.己烯雌酚的分子式为C18H20O2
A.己烯雌酚的分子式为C18H20O2
B.己烯雌酚分子中一定有16个碳原子共平面
C.己烯雌酚为芳香族化合物
D.己烯雌酚可发生加成、取代、氧化、加聚、酯化、硝化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:
 CO2(g)+3H2(g)
CO2(g)+3H2(g)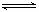 CH3OH(g)+H2O(g) △H=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。
CH3OH(g)+H2O(g) △H=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。
①能说明该反应已达平衡状态的是 。
A. CO2的体积分数在混合气体中保持不变
B. 混合气体的平均相对分子质量不随时间的变化而变化
C. 单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D. 反应中H2O与CH3OH的物质的量浓度之比为1:1,且 保持不变
②下列措施中能使 增大的是 (选填编号)。
增大的是 (选填编号)。
A.升高温度 B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离 D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K= 。若改变条件 (填选项),可使K=1。
A.增大压强 B.增大反应物浓度
C.降低温度 D.升高温度 E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。

①M区发生反应的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为
(忽略溶液体积变化)。
(3) 有一种用CO2生产甲醇燃料的方法:
已知: CO2(g)+3H2(g)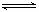 CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有一瓶无色溶液,其中可能含有NH4+、K+ 、Mg2+、Ba2+、Al3+ 、Fe3+、I-、Cl-、NO3-、CO32-、SO42-取该溶液进行以下实验:
①该溶液可使pH试纸呈红色;
②取少量溶液加新制氯水及CCl4振荡,可见CCl4层呈现紫色;
③取少量溶液加氯化钡溶液,有白色沉淀生成,加人HNO3后沉淀不溶解;
④取实验③之上层清液,加入硝酸银溶液有白色沉淀生成,加入HNO3后沉淀不溶解;
⑤取少量原溶液加入NaOH溶液呈碱性,在此过程中有白色沉淀生成,而后又逐渐消失,将此溶液加热,有无色气休放出,该气体能使润湿的红色石蕊试纸变蓝。
根据上述实验事实,溶液中肯定存在的离子有_____________________,肯定不存在的离子有_____________________,不能确定是否存在的离子有_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com