
| A. | 硫酸是铅蓄电池的电解质溶液,铅蓄电池可实现化学能转变成电能 | |
| B. | 硅酸干凝胶是硅酸干燥剂的主要成分,作用是吸收水分 | |
| C. | 肥皂的主要成分是硬脂酸钠,可以用于除去油污 | |
| D. | 二氧化硅是光能转化为电能的转化材料 |
分析 A、铅蓄电池属于原电池原理,以硫酸为电解质溶液,将化学能转变成电能;
B、硅酸干凝胶,可以吸收水分作干燥剂;
C、肥皂的成分是高级脂肪酸钠盐,水解显示碱性,能去除油污;
D、太阳能电池板的材料是:单晶硅、多晶硅、非晶硅.
解答 解:A、铅蓄电池属于原电池原理,以硫酸为电解质溶液,将化学能转变成电能,故A正确;
B、硅酸干凝胶,可以吸收水分作干燥剂,故B正确;
C、肥皂的成分是高级脂肪酸的钠盐,该钠盐水解显示碱性,肥皂能去除油污,故C正确;
D、硅是制造太阳能电池的材料,太阳能电池可以将光能转化为电能,不是二氧化硅,故D错误.
故选:D.
点评 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力.


科目:高中化学 来源: 题型:解答题
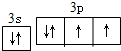 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下二氧化硅与碳酸钠反应放出二氧化碳,说明硅酸(H2SiO3)的酸性比碳酸强 | |
| B. | 陶瓷、玻璃、水泥容器都能贮存氢氟酸 | |
| C. | 石灰抹墙、水泥砌墙的硬化过程原理不相同 | |
| D. | 硫酸钠溶液、烧碱溶液、硝酸溶液、浓硫酸四种溶液均能用带玻璃塞的试剂瓶保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
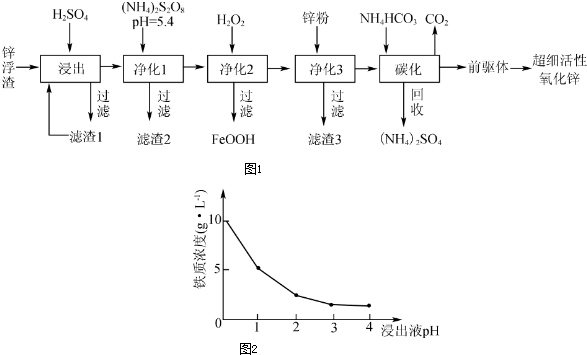
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
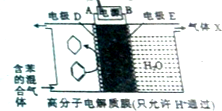
| A. | 电极D的电极反应式为C6H6+6H++6e-=C6H12 | |
| B. | 气体X在反应中通常体现还原性 | |
| C. | 电极D为惰性电极,E为活泼电极 | |
| D. | 外电路电子的移动方向:A→电源→B |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
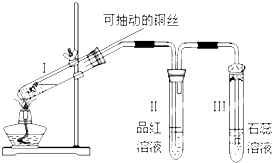
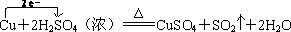 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究碳及其化合物的性质对于科研、生产生活具有重要意义.
研究碳及其化合物的性质对于科研、生产生活具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知CO和H2在一定条件下合成甲醇的反应为CO(g)+2H2(g)?CH3OH(g),现在容积固定且相等的a、b、c三个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度进行反应,测得相关数据的关系如图所示.下列说法正确的是( )
已知CO和H2在一定条件下合成甲醇的反应为CO(g)+2H2(g)?CH3OH(g),现在容积固定且相等的a、b、c三个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度进行反应,测得相关数据的关系如图所示.下列说法正确的是( )| A. | a容器中,0~5min反应速率v(H2)=0.08mol•L-1•min-1 | |
| B. | 反应进行到5min时,b容器中v正=v速 | |
| C. | 其他条件不变时,减压可将b中的状态转变成c中的状态 | |
| D. | 达到平衡时a、b、c容器中的转化率为b>a>c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com