
【题目】下列说法正确的是()
A.![]() 中,氧化剂和还原剂的物质的量之比为1:4
中,氧化剂和还原剂的物质的量之比为1:4
B.![]() 中,氧化产物和还原产物的质量之比为1:1
中,氧化产物和还原产物的质量之比为1:1
C.![]() 中,发生氧化反应和发生还原反应的氮元素的质量之比为5:3
中,发生氧化反应和发生还原反应的氮元素的质量之比为5:3
D.![]() 中,被氧化和被还原的硫元素的物质的量之比为1:1
中,被氧化和被还原的硫元素的物质的量之比为1:1
【答案】C
【解析】
A、化方程式MnO2+4HCl![]() MnCl2+Cl2↑+2H2O中,氧化剂是1mol的二氧化锰,还原剂是2mol的盐酸,另外2mol的盐酸显示酸性,即氧化剂和还原剂物质的量之比为1:2,A错误;
MnCl2+Cl2↑+2H2O中,氧化剂是1mol的二氧化锰,还原剂是2mol的盐酸,另外2mol的盐酸显示酸性,即氧化剂和还原剂物质的量之比为1:2,A错误;
B、2H2S+SO2=3S+2H2O中,氧化产物是化合价升高得到的硫单质为2mol,还原产物是化合价降低得到硫单质为1mol,氧化产物和还原产物的物质的量之比为2:1,B错误;
C、5NH4NO3=4N2↑+2HNO3+9H2O,NH4+中N的化合价为-3, 化合价升高得到N2,发生氧化反应,共5molNH4+,化合价升高;NO3-中N的化合价为+5,化合价降低得到N2,发生还原反应,但是5molNO3-中只有3molNO3-化合价降低,所以发生氧化反应和发生还原反应的氮元素的物质的量之比为5:3,C正确;
D、3S+6KOH=2K2S+K2SO3+3H2O中,被氧化的硫即化合价升高的硫,共有1mol,被还原的硫即化合价降低硫,共有2mol,所以被氧化和被还原的硫元素的物质的量之比为1:2,D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法不正确的是()
A.![]() 、
、![]() 、
、![]() 中只有
中只有![]() 可与酸性高锰酸钾溶液反应且所有原子处于同一平面
可与酸性高锰酸钾溶液反应且所有原子处于同一平面
B.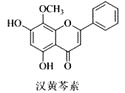 与足量
与足量![]() 发生加成反应后,该分子中官能团的种类减少2种
发生加成反应后,该分子中官能团的种类减少2种
C.以淀粉为有机原料可制取乙酸乙酯
D.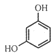 、
、![]() 均可作为聚合反应的单体
均可作为聚合反应的单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液,只含以下离子中的若干种:K+、NH4+、Ba2+、Cl﹣、NO3﹣、SO42﹣,现取三份100mL溶液分别进行如下实验:
①第一份加入稀硝酸无明显现象,再加入AgNO3溶液有沉淀产生
②第二份加足量NaOH溶液后加热,收集到气体0.04mol
③第三份加足量BaCl2溶液后,得沉淀4.66g,加盐酸,沉淀质量不变。
根据以上实验,回答下列问题:
(1)溶液中不能确定是否存在的离子是_____,一定存在的阴离子是_____
(2)实验③间接表明溶液中不存在的离子是_____,实验②发生反应的离子方程式为_____
(3)小明根据上述实验认为该溶液中一定存在的阳离子为NH4+和_____,判断的依据是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】建设“美丽中国”首先要做好环境保护与治理。氮氧化物(NOx)是严重的大气污染物,其主要来源有汽车尾气和硝酸工厂等。氮氧化物(NOX)能引起雾霾、光化学烟雾、酸雨等环境问题。某科研机构设计了如下转化氮氧化物的几种方案。请回答下列问题:
(1)方案Ⅰ:利用甲烷在催化剂条件下还原NOx,相关反应如下:
①N2(g)+O2(g)=2NO(g) H1=+180.5kJ/mol
②CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) H2= -574kJ/mol
③CH4(g)+4NO(g)=2N2(g)+ CO2(g)+2H2O(l) H3= -1160kJ/mol
则表示甲烷燃烧热的热化学反应方程式是________ 。
(2)方案Ⅱ:利用CO在催化剂条件下还原NOx:2NOx(g)+2xCO(g)N2(g)+2xCO2(g) H。向容积均为2L的甲(温度为T1)、乙(温度为T2)两个恒容密闭容器中分别充入2 mol NO2(g)和3 mol CO(g)。反应过程中两容器内CO2的物质的量浓度随时间的变化关系如图所示:

①甲容器中,平衡时NO2的转化率为____;
②T1___T2(填“>”或“<”);△H___0(填“>”或“<”),判定的依据是____;
③T2温度时,该反应的平衡常数K=____;
④乙容器达到平衡后,再充入3 mol NO2和2 molCO2,此时v(正)___v(逆)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物应用广泛,但氮氧化物是重要的空气污染物,应降低其排放。
(1)用CO2和NH3可合成氮肥尿素[CO(NH2)2]
已知:①2NH3(g)+CO2(g)=NH2CO2NH4 (s) △H=-151.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+120.5 kJ·mol-1
③H2O(l)=H2O(g) △H=+44 kJ·mol-1
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为______________________
(2)工业上常用如下反应消除氮氧化物的污染:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H,在温度为T1和T2时,分别将0.40molCH4和0.9molNO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示:
N2(g)+CO2(g)+2H2O(g) △H,在温度为T1和T2时,分别将0.40molCH4和0.9molNO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示:
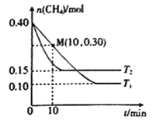
①根据图判断该反应的△H______0(填“>”、“<”或“=”)。
②温度为T1时,0~10min内NO2的平均反应速率v(NO2)=__________,反应的平衡常数K=_________ 。
③该反应达到平衡后,为在提高反应速率同时提高NO2的转化率,可采取的措施有______(填标号)。
A.改用高效催化剂 B.增加CH4的浓度 C.缩小容器的体积 D.升高温度
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为HCl溶液,工作一段时间后,负极的电极反应式为________________。
(4)氮的一种氢化物HN3,其水溶液酸性与醋酸相似,则NaN3溶液中各离子浓度由大到小的顺序为________________;常温下,将amol/L的Ba(OH) 2 与bmol/L的HN3溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N3-),则该溶液中c(HN3)=_________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
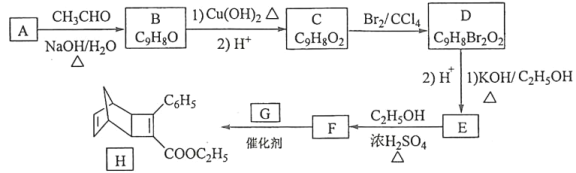
已知:
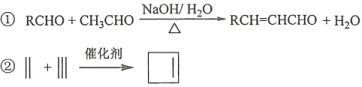
回答下列问题:
(1)A的化学名称是__________。
(2)由C生成D和E生成F的反应类型分别是__________、_________。
(3)E的结构简式为____________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,写出2种符合要求的X的结构简式____________。
(6)写出用环戊烷和2–丁炔为原料制备化合物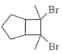 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气:KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目。________。
(2)将上述配平的化学方程式改写为离子方程式________。
(3)浓盐酸在反应中显示出来的性质是________。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)若产生0.5mol Cl2,则被氧化的HCl ____mol,转移的电子的数目约为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列说法正确的是( )
![]()
A.原子半径Q>R>T
B.原子序数比R多1的元素只能形成一种氢化物
C.W原子得电子能力强于Q原子,且可形成共价化合物QW2
D.与W同一主族的下一周期元素不可作为半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: +4NaOH→CH2=CH2↑+NaCl+Na3PO4+3H2O。可用下述装置制取1,2-二溴乙烷(无色液体,密度2.18g·cm-3,熔、沸点为9.79℃、131.4℃,不溶于水);试管d中装有适量液溴(表面覆盖少量水)。
+4NaOH→CH2=CH2↑+NaCl+Na3PO4+3H2O。可用下述装置制取1,2-二溴乙烷(无色液体,密度2.18g·cm-3,熔、沸点为9.79℃、131.4℃,不溶于水);试管d中装有适量液溴(表面覆盖少量水)。

(1)e装置的作用是_______________;当观察到______________________________现象时,试管d中反应基本结束。
(2)若用冰水代替烧杯中的冷水,可能引起的不安全后果是_________________________。
(3)实验结束后精制试管d中粗产品,操作先后顺序是___________________。
A.蒸馏 B.水洗 C.用干燥剂干燥 D.10%NaOH溶液洗
(4)实验消耗40%乙烯利溶液50g,制得产品mg,则乙烯利合成1,2-二溴乙烷的产率为________________(列出含m的计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com