

| A. | 原混合物中铜元素的质量不一定为0.64g | |
| B. | 生成气体体积为2.016L | |
| C. | 实验中反应的硫酸的物质的量为0.1mol | |
| D. | 原混合物中铁的质量分数为78.5% |
分析 生成可燃性气体,说明铁粉过量,发生反应Fe+H2SO4=FeSO4+H2↑,反应后的溶液为浅绿色,且只有一种金属离子,则发生反应CuO+H2SO4=CuSO4+H2O后,又发生CuSO4+Fe=FeSO4+Cu,且Cu被完全置换;根据Cu的质量计算CuO质量,进而计算Fe的质量,根据电子转移计算生成氢气的质量.
解答 解:生成可燃性气体,说明发生反应Fe+H2SO4=FeSO4+H2↑,溶液为浅绿色,只有一种金属离子,则发生CuO+H2SO4=CuSO4+H2O后,又发生CuSO4+Fe=FeSO4+Cu,且Cu被完全置换,
生成0.64gCu,其物质的量:$\frac{0.64g}{64g/mol}$=0.01mol,由Cu元素守恒可知n(CuO)=n(Cu)=0.01mol,
故混合物中:m(CuO)=0.01mol×80g/mol=0.8g,则:m(Fe)=6.40g-0.8g=5.6g,n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,
A.根据分析可知,铜的质量为0.64g,故A错误;
B.设氢气的物质的量为nmol,根据电子转移守恒可得:2n+0.01mol×2=0.1mol×2,解得n=0.09mol,没有告诉在标准状况下,不能使用标准状况下气体摩尔体积计算氢气体积,故B错误;
C.铁的物质的量为0.1mol,反应生成溶质为硫酸亚铁,则反应消耗的硫酸的物质的量为0.1mol,故C正确;
D.由上述分析可知,Fe的质量为5.6g,混合物中Fe的质量分数为:$\frac{5.6g}{6.4g}$×100%=87.5%,故D错误;
故选C.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题

| A. | 原子半径:W<X<Y<Z | B. | 阴离子的还原性:Y>W | ||
| C. | 简单气态氢化物的热稳定性:Y>X | D. | a一定由W、X两种元素组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为正极,Ag2O为负极 | |
| B. | 锌为负极,Ag2O为正极 | |
| C. | 原电池工作时,将电能转化成化学能 | |
| D. | 原电池工作时,负极区溶液pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
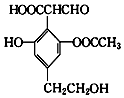
| A. | 该物质可以使酸性KMnO4溶液褪色,也可发生消去反应 | |
| B. | 该物质可与H2反应,1mol该物质最多消耗5mol H2 | |
| C. | 可以与FeCl3溶液反应显色,也可与Ag(NH3)2OH反应 | |
| D. | 可以与NaHCO3溶液反应放出CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| ①Zn为正极,Cu为负极 ②H+向负极移动 ③Cu极有H2产生 ④电子流动方向Zn→Cu ⑤正极的电极反应式是Zn-2e-=Zn2+ ⑥若有1mol电子流过导线,则理论上产生0.5mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑥ | C. | ①②③⑤ | D. | ①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
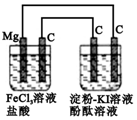
| A. | 电解池中阳极区溶液变红,阴极区溶液变蓝 | |
| B. | 原电池中碳极的电极反应式为:Fe3++e-═Fe2+ | |
| C. | 镁为负极,发生氧化反应 | |
| D. | 电解池中阴极的电极反应式为:2H++e-═H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com