
下列电离方程式书写正确的是( )
|
| A. | NaHCO3=Na++H++CO32﹣ | B. | HF⇌H++F﹣ |
|
| C. | H2CO3⇌2H++CO32﹣ | D. | CH3COONH4⇌CH3COO﹣+NH4+ |
考点:
电离方程式的书写.
专题:
电离平衡与溶液的pH专题.
分析:
A.碳酸氢根为多元弱酸的酸式根离子不能拆;
B.氢氟酸为弱电解质,部分电离;
C.碳酸为多元弱酸分步电离,以第一步电离为主;
D.醋酸铵为强电解质,完全电离,用等号.
解答:
解:A.碳酸氢钠电离的方程式为:NaHCO3=Na++HCO3﹣,故A错误;
B.氢氟酸电离的方程式为:HF⇌H++F﹣,故B正确;
C.碳酸电离方程式为:H2CO3⇌H++HCO3﹣,故C错误;
D.醋酸铵电离的方程式为:CH3COONH4=CH3COO﹣+NH4+,故D错误;
故选:B.
点评:
本题考查电离方程式的书写知识,明确电解质的强弱、电离方程式书写的原子是解题的关键,注意碳酸为多元弱酸分步电离,以第一步为主.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用.它的有效成分是下列物质中的一种,这种物质是( )
|
| A. | NaOH | B. | NaClO | C. | KMnO4 | D. | Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
金属原子在二维空间里的放置如图所示的两种方式,下列说法中正确的是( )

|
| A. | 图(a)为非密置层,配位数为6 |
|
| B. | 图(b)为密置层,配位数为4 |
|
| C. | 图(a)在三维空间里堆积可得六方最密堆积和面心立方最密堆积 |
|
| D. | 图(b)在三维空间里堆积仅得简单立方 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为 熔化时不需破坏化学键的是 ,熔化时只需破坏共价键的是 (填序号).
(2)在①H2、②(NH4)2SO4、③SiC、④CO2、⑤HF中,由极性键形成的非极性分子有 ,由非极性键形成的非极性分子有 ,能形成分子晶体的物质是 ,含有氢键的晶体的化学式是 ,属于离子晶体的是 ,属于原子晶体的是 .(填序号)
(3)如图表示一些晶体的结构中的某一部分.
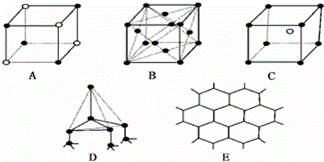
①代表金刚石的是(填编号字母,下同) ,其中每个碳原子与 个碳原子最接近且距离相等.
②代表NaCl的是 ,每个Na+周围与它最接近且距离相等的Na+有 个.
③代表CsCl的是 ,每个Cs+与 个Cl﹣紧邻.
④代表干冰的是 ,每个CO2分子与 个CO2分子紧邻.
⑤代表石墨的是 ,它属于 晶体.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质全部是弱电解质的是( )
|
| A. | H2O、NH3•H2O、H3PO4、HF |
|
| B. | Cu(OH)2、CH3COOH、C2H5OH、CH3COONa |
|
| C. | H2SO3、Ba(OH)2、BaSO4 Fe |
|
| D. | H2SiO3、H2S、CO2 NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知“凡气体分子总数增多的反应一定是熵增大的反应”.根据所学知识判断,下列反应中,在所有温度下都不自发进行的( )
|
| A. | 2O3(g)═3O2(g)△H<0 | B. | 2CO(g)═2C(s)+O2(g)△H>0 |
|
| C. | N2(g)+3H2(g)═2NH3(g)△H<0 | D. | CaCO3(s)═CaO(s)+CO2(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
反应m A+n B⇌p C在某温度下达到平衡.
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是 .
②若C为气体,且m+n=p,在加压时化学平衡发生移动,则平衡必定向 方向移动.
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为 态.
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如表所示:
| 湿法 | 强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
(1)某工厂用湿法制备高铁酸钾的流程如图所示:
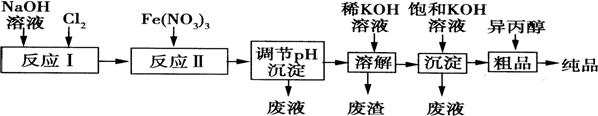
①反应I的化学方程式为 。
②反应Ⅱ的离子方程式为 。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整
pH= 时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2 (填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为 。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是一种可再生燃料。在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)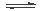 CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示。
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示。
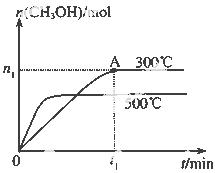
(1)该反应的△H 0 (填>、<或=)
(2)300℃时,0-t1 min内 CH3OH的平均生成速率为
(3)若要提高甲醇的产率,可采取的措施有_________ 。(填字母)
A.缩小容器体积 B.降低温度
C.升高温度 D.使用合适的催化剂
E.甲醇从混合体系中分离出来
(4)300℃时,CO、H2的起始物质的量分别为2mol和3mol,若图中n1数据为0.5mol,试计算300℃下,该反应的平衡常数(写出计算过程,保留两位有效数字)
(5)工业上也可以用CO2和H2反应制得甲醇。在2×105Pa、300℃的条件下,若有440g CO2与H2恰好完全反应生成甲醇和水,放出495kJ的热量,试写出该反应的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com