
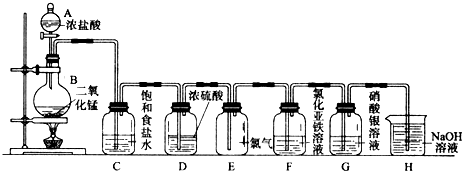
在盛有AgNO3、HCl、Na2CO3、CaCl2、NaCl五种无色溶液的试剂瓶上,分别贴有①~⑤的编号.将它们两两混合,产生的现象如右表所列(其中“↑”表示产生气体,“↓”表示生成沉淀,“-”表示无现象):

(1)写出③、④、⑤三种物质的化学式为:③________,④________,⑤________.
(2)写出下列反应的离子方程式:①+②________.
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
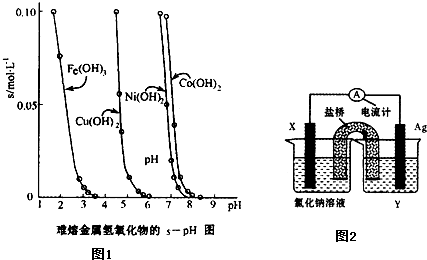
科目:高中化学 来源: 题型:
| O | - 3 |
| O | 2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| [CO] | [CO2] |
查看答案和解析>>
科目:高中化学 来源:2015届福建省福州市八县高二上学期期末考试化学试卷(解析版) 题型:填空题
(1)已知:C3H8(g)+5O2(g) ===3CO2(g)+4H2O(1) △H=-2220.0kJ/mol
H2O(1) ===H2O(g);△H=+44.0kJ/mol
写出丙烷燃烧生成CO2和气态水的热化学方程式 。
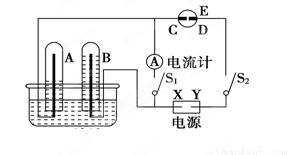
(2)在如图所示的实验装置中,E为一张用淀粉碘化钾溶液润湿的滤纸,C、D为夹在滤纸两端的铂夹,X、Y分别为直流电源的两极。在A、B中充满AgNO3溶液后倒立于盛有AgNO3溶液的水槽中,再分别插入铂电极。切断电源开关S1,闭合开关S2,通直流电一段时间后,B电极质量增重,A极产生无色气体。请回答下列问题:
① 写出D电极反应式: ;
②写出水槽中电解AgNO3溶液总反应的离子方程式: ,阴极增重2.16 g,则阳极上放出的气体在标准状况下的体积是____ _L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com