
【题目】关于下列图象说法正确的是
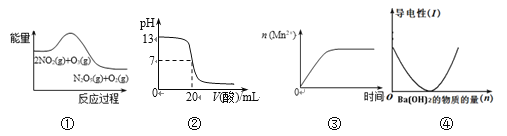
A. ①表示化学反应2NO2(g) + O3(g) = N2O5(g) + O2(g) ΔH > 0
B. ②表示25℃时,用0.1 mol/L CH3COOH溶液滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化
C. ③表示10 mL 0.01 mol/L酸性KMnO4溶液与过量的0.1 mol/L H2C2O4溶液混合时, n (Mn2+) 随时间的变化
D. ④可表示向稀硫酸溶液中滴加氢氧化钡溶液,溶液导电性随氢氧化钡物质的量的变化
【答案】D
【解析】
A. 反应物所具有的总能量大于生成物所具有的总能量, 反应物转化为生成物时就放出能量,故2NO2(g) + O3(g) = N2O5(g) + O2(g) ΔH < 0,故A错误;
B.v(酸)=20mL时,生成物为醋酸钠,其水溶液呈碱性,故B错误;
C.反应生成的Mn2+对该反应有催化作用,所以曲线斜率有突变,故C错误;
D. 氢氧化钡和稀硫酸反应后生成了不溶于水的硫酸钡和水,它们都不导电,所以往稀硫酸中滴加氢氧化钡溶液,会使溶液中的导电离子逐渐减少,直至为零,继续滴加氢氧化钡溶液至过量,氢氧化钡会电离出钡离子、硫酸根离子,所以溶液的导电性又逐渐增强。
故选D。


科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“飘尘”是物质燃烧时产生的粒子漂浮物,颗粒很小(直径小于10-7m),不易沉降(可漂浮数小时甚至数年),它与空气中SO2、O2接触时,SO2部分转化为SO3,使空气中酸度增加形成酸雨。
(1)下列关于SO2的叙述中,正确的是_____;
A.SO2既可以做氧化剂,也可以做还原剂 B.SO2不是大汽污染物 C.大气中SO2的主要来源是汽车排出的尾气 D.SO2具有漂白性,因而可以使石蕊溶液褪色
(2)下列反应中,SO2表现了还原性的是_______;
A.SO2+H2OH2SO3 B.SO2+2NaOH=Na2CO3+H2O C.2SO2+O2![]() 2SO3 D.SO2+CaO=CaSO3
2SO3 D.SO2+CaO=CaSO3
(3)不能鉴别二氧化碳和二氧化硫的试剂是________;
A.品红溶液 B.澄清石灰水 C.溴水 D.酸性高锰酸钾溶液
(4)下列哪种危害不是酸雨导致的_______;
A.造成洪涝灾害 B.腐蚀建筑物 C.恶化人类环境 D.导致树木枯萎
(5)根据SO2通入不同溶液中实验现象,所得结论不正确的是_______;
溶液 | 现象 | 结论 | |
A | 含HCl、BaCl2的FeCl3溶液 | 产生白色沉淀 | SO2有还原性 |
B | H2S溶液 | 产生黄色沉淀 | SO2有氧化性 |
C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有漂白性 |
D | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 |
(6)减少酸雨产生的途径可采取下列的哪些措施___________。
①少用煤做燃料 ②把工厂烟囱造高 ③燃料脱硫 ④飞机、汽车等交通工具采用清洁燃料,如天然气等 ⑤开发新能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碘伏”又叫“聚维酮碘溶液”。聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如图所示。下列说法正确的是
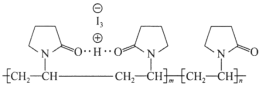 (图中虚线表示氢键)
(图中虚线表示氢键)
A.C、N、O原子的电负性依次增大
B.聚维酮碘中含有离子键、共价键、氢键等化学键
C.聚维酮易溶于水的原因是与水分子间形成氢键
D.分子中的含N五元环一定是平面结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计如图所示装置制取较多量乙酸乙酯。已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
下列说法正确的是
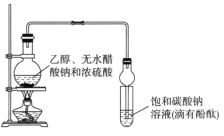
A.装置中球形管既能冷凝蒸气又能防止倒吸
B.反应结束后大试管中的现象是:溶液分层,下层无色油状液体;上层溶液颜色变浅
C.从大试管中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,过滤分离出乙醇
D.最后加入无水硫酸钠,然后进行蒸馏,收集118℃左右的馏分,以得到较纯净的乙酸乙酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是( )
CO(g)+3H2(g) △H>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是( )
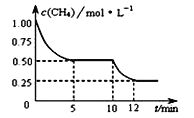
A. 10 min时,改变的外界条件可能是升高温度
B. 反应进行到12min时,CH4的转化率为25%
C. 0∽5 min内,v(H2)=0.1 mol·(L·min)-1
D. 恒温下,缩小容器体积,平衡后H2浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是( )
装置 |
|
|
|
现象 | 金属W不断溶解 | Y的质量增加 | W上有气体产生 |
A.装置甲中X作原电池正极
B.装置乙中Y电极上的反应式为Cu2++2e=Cu
C.装置丙中溶液的c(H+)不变
D.四种金属的活动性强弱顺序为Z>W>X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯与液溴制取溴苯:

(1)装置A的名称是_______________。
(2)制取溴苯的化学反应方程式_____________。
(3)反应时,装置B中出现的现象有___________。
(4)冷凝水顺序_______(A.上进下出;B.下进上出),长导管的作用____________,请解释装置C中导管位置为什么不能伸入液面以下____________。
(5)装置D的作用是__________。
(6)反应结束后,将滴液漏斗中的溶液E加入到烧瓶B中,充分振荡后可除去溴苯中的溴,溶液E是_______________;液体经过分液,所得的溴苯中还含有少量苯,如何进行分离________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图:
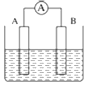
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为______。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成原电池的负极反应式_________。
(2)若A为Pb,B为PbO2,电解质为硫酸溶液,写出B电极反应式:_________;该电池在工作时,A电极的质量将______(填“增重”或“减轻”或“不变”)。若消耗0.1moLH2SO4时,则转移电子数目为______。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃烧电池,写出A电极反应式:_________;该电池在工作一段时间后,溶液的碱性将______(填“增强”或“减弱”或“不变”)。
(4)若A、B均为铂片,电解质为硫酸溶液,分别从A、B两极通入CH4和O2,该电池即为甲烷燃烧电池,写出A电极反应式:_________;电池工作时阴离子定向移动到______极(填“正”或“负”)。
(5)铁、铜、铝是生活中使用广泛的金属,FeCl3溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为_________,若将此反应设计成原电池,则负极所用电极材料为______,正极反应式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com