
 如图:A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图:A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
| ||
| ||


科目:高中化学 来源: 题型:
| A、NaHCO3溶液中加入NaOH 溶液:HCO3-+OH-═CO2↑+H2O |
| B、在NaOH溶液中滴入少量AlCl3溶液:Al3++3OH-═Al(OH)3↓ |
| C、甲酸溶液中滴入NaOH溶液:HCOOH+OH-═HCOO-+H2O |
| D、CO2通入CaCl2溶液:CO2+H2O+Ca2+═CaCO3↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、③④ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| A | 该元素有一种核素质量数为1 |
| B | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| C | 形成的简单离子是第三周期元素形成简单离子半径中最小的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
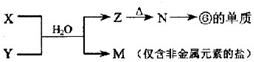
查看答案和解析>>
科目:高中化学 来源: 题型:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
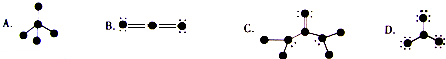
查看答案和解析>>
科目:高中化学 来源: 题型:
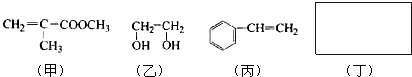
| △ |
| 稀硫酸 |
| △ |
| 一定条件 |
| 浓硫酸 |
| 170℃ |
| 试剂X |
| NaOH溶液 |
| △ |
 利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤ | B、②③④ |
| C、①②⑥ | D、②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com