
【题目】银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照相器材等领域亦有广泛应用![]() 回答下列问题:
回答下列问题:
(1)久存的银制品表面会变黑,失去银白色光泽,原因是 ____________________ .
(2)已知![]() ,若向
,若向![]() 的
的![]() 溶液中加入
溶液中加入![]() 的盐酸,混合后溶液中
的盐酸,混合后溶液中![]() 的浓度为 ______________
的浓度为 ______________ ![]() ,pH为 _______________ .
,pH为 _______________ .
(3)![]() 光照易分解,生成Ag和红棕色气体等物质,其光照分解反应的化学方程式为 _______________________________________ .
光照易分解,生成Ag和红棕色气体等物质,其光照分解反应的化学方程式为 _______________________________________ .
(4)如图所示原电池正极的反应式为________________________________________ .

【答案】 Ag与空气中微量![]() 反应生成黑色的
反应生成黑色的![]()
![]() 2
2 ![]()
![]()
【解析】 Ag与空气中微量![]() 反应生成黑色的
反应生成黑色的![]() 。若向
。若向![]() 的
的![]() 溶液中加入
溶液中加入![]() 的盐酸,两者反应后盐酸剩余,反应后c(Cl-)=0.5
的盐酸,两者反应后盐酸剩余,反应后c(Cl-)=0.5![]() (
(![]() )=
)=![]() ,混合后溶液中
,混合后溶液中![]() 的浓度为
的浓度为![]()
![]() ,盐酸中氢离子不参与离子反应,故两溶液混合后c(H+)=
,盐酸中氢离子不参与离子反应,故两溶液混合后c(H+)=![]() ,pH为2.
,pH为2.![]() 光照易分解,生成Ag和红棕色气体等物质,红棕色气体为二氧化氮,根据化合价的变化规律,可以判断一定有氧气生成。原电池的正极发生还原反应。
光照易分解,生成Ag和红棕色气体等物质,红棕色气体为二氧化氮,根据化合价的变化规律,可以判断一定有氧气生成。原电池的正极发生还原反应。
(1)久存的银制品表面会变黑,失去银白色光泽,原因是Ag与空气中微量![]() 反应生成黑色的
反应生成黑色的![]() .
.
(2)已知![]() ,若向
,若向![]() 的
的![]() 溶液中加入
溶液中加入![]() 的盐酸,两者反应后盐酸剩余,反应后c(Cl-)=0.5
的盐酸,两者反应后盐酸剩余,反应后c(Cl-)=0.5![]() (
(![]() )=
)=![]() ,混合后溶液中
,混合后溶液中![]() 的浓度为
的浓度为![]()
![]() ,盐酸中氢离子不参与离子反应,故两溶液混合后c(H+)=
,盐酸中氢离子不参与离子反应,故两溶液混合后c(H+)=![]() ,pH为2.
,pH为2.
(3)![]() 光照易分解,生成Ag和红棕色气体等物质,红棕色气体为二氧化氮,根据化合价的变化规律,可以判断一定有氧气生成,故其光照分解反应的化学方程式为
光照易分解,生成Ag和红棕色气体等物质,红棕色气体为二氧化氮,根据化合价的变化规律,可以判断一定有氧气生成,故其光照分解反应的化学方程式为 ![]() .
.
(4)由图可知,该原电池的负极为铜、正极为银,正极发生还原反应,其反应式为![]() .
.


科目:高中化学 来源: 题型:
【题目】下图是无机物 A~J在一定条件下的转化关系(部分产物及反应条件未列出)。其中C为红棕色气体;H和I是两种常见的金属单质;过量I与 D溶液反应生成A。

请填写下列空白:
(1)H元素在周期表中的位置是________;写出①的离子反应方程式:_________;检验E溶液中阳离子的最佳试剂为________。
(2)这类反应常用于冶炼高熔点的金属。用MnO2冶炼金属锰的反应中氧化剂与还原剂的物质的量之比为__________。
(3)SCR技术处理机动车尾气时,在催化条件下利用氨气与C反应,生成无污染的物质。发生反应的化学方程式为__________。
(4)F与NaClO、NaOH溶液反应,可制得一种“绿色”高效净水剂K2FeO4。每生成1molFeO42-时转移____________mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y 能用于高性能光学树脂的合成,可由化合物X与2 甲基丙烯酰氯在一定条件下反应制得:

下列有关化合物X、Y 的说法不正确的是
A. X 分子中所有原子一定在同一平面上
B. Y与Br2的加成产物分子中含有手性碳原子
C. X、Y均能使酸性KMnO4溶液褪色
D. X→Y的反应为取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是![]()
![]()
A. 向![]() 溶液中加入少量水,溶液中
溶液中加入少量水,溶液中![]() 减小
减小
B. 将![]() 溶液从
溶液从![]() 升温至
升温至![]() ,溶液中
,溶液中![]() 增大
增大
C. 向盐酸中加入氨水至中性,溶液中![]()
D. 向AgCl、AgBr的饱和溶液中加入少量![]() ,溶液中
,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍配合物在传感器、磁记录材料、储氢材料、电极催化剂和化学键研究等方面有着广泛的应用。以纯镍片为原料制备一种镍配合物[Ni(NH3)xCly]Clz·nH2O的主要流程如下:
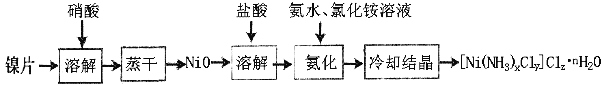
(1)工业上镍氢电池总反应式为:LaNi5H6 + NiOOH ![]() LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为:_______________________
LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为:_______________________
(2)常温下,镍投入60%的浓硝酸无明显现象,流程中需控制反应温度50-60oC,控温原因可能是_______,写出离子反应方程式:____________________________。
(3)冷却结晶后洗涤、过滤、干燥得到[Ni(NH3)xCly]Clz·nH2O,其中洗涤的正确操作是___________________________________________________________________。
(4)氨化过程中应控制溶液pH范围8~9,其原因是_____________________________。上述流程中,有关说法正确的是___________
A.氨化操作为在过量氨水和氯化铵缓冲溶液中,缓慢滴入酸化的NiCl2溶液,并不断搅拌
B.此缓冲溶液中微粒浓度大小顺序为:c(Cl—)> c(NH3·H2O) >c(NH4+) > c(OH—)> c(H+)
C.冷却结晶后的母液加适量氨水调节pH后可以循环利用
D.可以用热的浓硫酸和浓硝酸混合溶液代替浓硝酸溶解镍片
(5)为测定化合物[Ni(NH3)xCly]Clz·nH2O的组成,进行如下实验:
实验一:称取样品0.6460 g,加入过量的浓NaOH溶液,煮沸,冷却,蒸出的氨用40.00 mL 0.5000 mol·L-1的盐酸完全吸收,并用蒸馏水定容至100 mL,得溶液B。取B溶液20.00 mL,加入指示剂少量,用0.1000 mol·L-1NaOH滴定,消耗NaOH溶液20.00 mL。
实验二:另取该样品0.6460 g,溶于水,以0.1000 mol·L-1AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00 mL。相应反应化学方程式为: [Ni(NH3)xCly]Clz+zAgNO3=[Ni (NH3)xCly] (NO3)z+zAgCl↓ 测得该镍配合物的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳碳单键可以绕键轴自由旋转,有关结构简式为 ![]() 的烃的下列说法不正确的是( )
的烃的下列说法不正确的是( )
A. 分子式为C16H18
B. 分子中至少有11个碳原子处于同一平面上
C. 属于苯的同系物
D. 一氯代物存在5种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1985年,Rousssin研究发现了第一个金属原子簇类配位化合物,其结构如图1,金属原子簇类化合物与金属原子表面性质相似,具有良好的催化活性等功能。请回答下列问题:
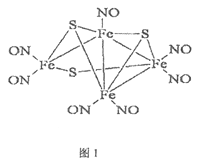
(1)Fe3+的基态核外价电子排布式为___________。
(2)上述化合物中含有三种非金属元素,试比较三种元素原子第一电离能由大到小顺序为_________;硫可以形成SOCl2化合物,则该化合物的空间构型为__________。
(3)除了氮的氧化物之外,氮还可以形成NO2+。请写出氮原子杂化方式____________。
(4)上述原子簇类配合物,中心原子铁的配位原子是___________。
(5)配合物Fe(CO)5的熔点-20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如下图所示。下列关于Fe(CO)5说法正确的是_________。
A. Fe(CO)5是非极性分子,CO是极性分子
B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C. 1mol Fe(CO)5含有10 mol配位键
D. Fe(CO)5 = Fe+5 CO反应中没有新化学键生成
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】一定温度下,反应N2(g)+3H2(g)![]() 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A. c(N2):c(H2):c(NH3)=1:3:2
B. N2、H2和NH3的物质的量分数不再改变
C. N2与H2的物质的量之和是NH3的物质的量的2倍
D. 单位时间里每增加lmolN2,同时增加3molH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com