
【题目】孟鲁司特钠可用于抗新型冠状病毒肺炎,其制备中间体G 的一种合成路线如下:
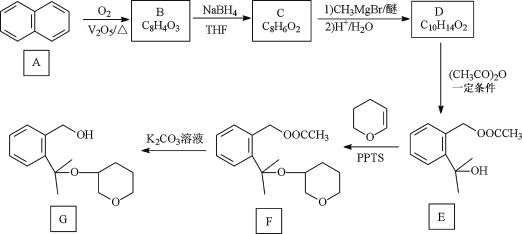
已知:① B、C除苯环外还含有一个五元环,D的苯环上只有两个取代基;
②RX![]() RMgX
RMgX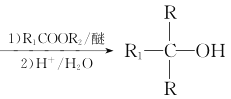
回答下列问题:
(1)A 的化学名称是____________________。
(2)F中含氧官能团名称是____________________________。
(3)B的结构简式为 ______________________________________。
(4)D生成E同时生成乙酸的化学方程式为___________________________________。
(5)E生成F的反应类型是________________。
(6)化合物 W 与G 互为同分异构体,能发生水解反应,其核磁共振氢谱有四组峰且峰面积之比为9:9:2:2,则 W 的结构简式为_____________________(写一种) 。
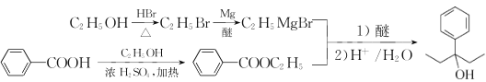
(7)设计以苯甲酸和乙醇为起始原料制备3-苯基-3-戊醇(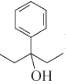 )的合成路线: _____________________________________________(无机试剂及有机溶剂任用) 。
)的合成路线: _____________________________________________(无机试剂及有机溶剂任用) 。
【答案】萘 醚键、酯基 
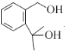 +(CH3CO)2O
+(CH3CO)2O![]()
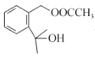 + CH3COOH 加成反应
+ CH3COOH 加成反应 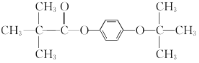 或
或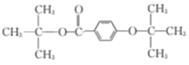
【解析】
A为![]() ,由B的分子式结合信息①,可确定B的结构简式为
,由B的分子式结合信息①,可确定B的结构简式为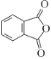 ;由C的分子式,结合信息①,参照E的结构,可确定C的结构简式为
;由C的分子式,结合信息①,参照E的结构,可确定C的结构简式为![]() ;由D的分子式结合E的结构,可确定D结构简式为
;由D的分子式结合E的结构,可确定D结构简式为![]() ;E与
;E与 发生加成反应生成F;F在碱性条件下水解生成G。据此解答。
发生加成反应生成F;F在碱性条件下水解生成G。据此解答。
(1)A 为![]() ,化学名称是萘。答案为:萘;
,化学名称是萘。答案为:萘;
(2)F的结构简式为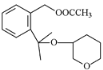 ,含氧官能团名称是醚键、酯基。答案为:醚键、酯基;
,含氧官能团名称是醚键、酯基。答案为:醚键、酯基;
(3)由以上分析,可得出B的结构简式为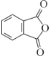 。答案为:
。答案为: ;
;
(4)  生成
生成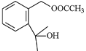 同时生成乙酸的化学方程式为
同时生成乙酸的化学方程式为![]() +(CH3CO)2O
+(CH3CO)2O![]()
 + CH3COOH。答案为:
+ CH3COOH。答案为: +(CH3CO)2O
+(CH3CO)2O![]()
 + CH3COOH;
+ CH3COOH;
(5) 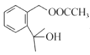 与
与 反应生成
反应生成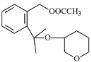 的反应类型是加成反应。答案为:加成反应;
的反应类型是加成反应。答案为:加成反应;
(6)化合物 W 与G 互为同分异构体,能发生水解反应,则含有酯基,即含有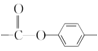 或
或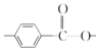 结构片断,核磁共振氢谱有四组峰且峰面积之比为9:9:2:2,则苯环上的两个取代基应在对位,且存在两组
结构片断,核磁共振氢谱有四组峰且峰面积之比为9:9:2:2,则苯环上的两个取代基应在对位,且存在两组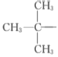 ,则同分异构体的结构简式为
,则同分异构体的结构简式为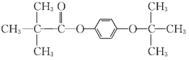 或
或 。答案为:
。答案为: 或
或 ;
;
(7)从信息看,应将苯甲酸转化为苯甲酸酯,然后与CH3CH2MgBr发生反应,而CH3CH2MgBr又需将乙醇转化为CH3CH2Br,进而转化为CH3CH2MgBr。合成路线: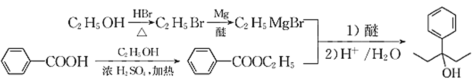 。答案为:
。答案为: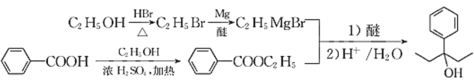 。
。


科目:高中化学 来源: 题型:
【题目】下列物质的化学用语表达正确的是( )
A.甲烷的球棍模型: ![]() B.羟基的电子式:
B.羟基的电子式: ![]()
C.乙醛的结构式:CH3CHOD.(CH3)3COH的名称:2,2-二甲基乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L容器中三种物质的物质的量随时间的变化曲线如下图所示。由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均反应速率为( )
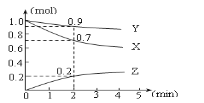
A.3X + Y ![]() 2Z;0.05mol·L-1·min-1B.2X + Y
2Z;0.05mol·L-1·min-1B.2X + Y![]() 2Z;0.1mol·L-1·min-1
2Z;0.1mol·L-1·min-1
C.X + 2Y =Z;0.1mol·L-1·min-1D.X + 3Y =2Z;0.05mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中,一定条件下发生反应:2A(?) ![]() B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是 ( )
B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是 ( )
A.升高温度,正反应速率增大,逆反应速率减小B.若正反应是放热反应,则A为气态
C.物质A一定为非气态,且正反应是吸热反应D.若向容器中充入惰性气体,则平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g)![]() 2NO(g),△H>0,已知该反应在240℃,平衡常数K=64×10-4。请回答:
2NO(g),△H>0,已知该反应在240℃,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率为______。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志______.
A.消耗1molN2同时生成1molO2![]() 混合气体密度不变
混合气体密度不变
C.混合气体平均相对分子质量不变D.2v正(N2)=v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是______(填字母序号)。

(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态![]() 与原平衡状态相比,此时平衡混合气中NO的体积分数______
与原平衡状态相比,此时平衡混合气中NO的体积分数______![]() 填“变大”、“变小”或“不变”
填“变大”、“变小”或“不变”![]()
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应______(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷(或氢气、一氧化碳等可燃性气体)和氧气构成燃料电池,则通入甲烷气体的一极是原电池的____极,该极的电极反应式是____,电池工作时的总反应的离子方程式是_____。
(2)熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极气体,空气与CO2的混合气体为正极气体,制得650 ℃下工作的燃料电池,完成下列反应式:
正极:_______,
负极:2CO+2CO32--4e-=4CO2。
总反应:______。
(3)铅蓄电池放电时,总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O,由此可以判断:
①原电池的电极材料:负极:__。
②电极反应式:正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O,负极反应式为_______。
③工作后,铅蓄电池里电解质溶液的pH____(填“变大”“变小”或“不变”),理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L恒容密闭容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t1 min 时达到平衡。
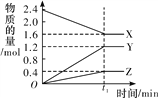
(1)请写出该反应的化学方程式:_____________________________。
(2)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为________;在此t1 min时间内,用H2表示该反应的平均速率v(H2)为__________。下列叙述能判断该反应达到平衡状态的是________(填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.正反应速率与逆反应速率相等
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上乙醚可用于制造无烟火药。实验室合成乙醚的原理如下:2CH3CH2OH![]() CH3CH2OCH2CH3+H2O。
CH3CH2OCH2CH3+H2O。
(乙醚制备)装置设计如图(部分装置略)
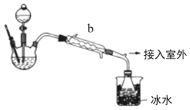
(1)仪器b应更换为下列的___(填序号)。
A.干燥器 B.直形冷凝管 C.玻璃管 D.安全瓶
(2)反应温度控制在145℃,还需添加___以防止局部过热,若温度过高,会生成一种能催熟果实的气体,则副反应化学方程式为:___。
(3)反应时,若滴入乙醇的速率显著超过馏出液速率,反应速率会降低,可能原因是___。
(乙醚提纯)
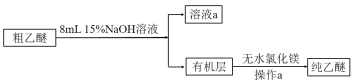
(4)粗乙醚中含有的主要杂质为___;操作a的名称是___;无水氯化镁的作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥少量MgSO4固体
A. ①②③⑤B. ③C. ③④⑥D. ③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com