
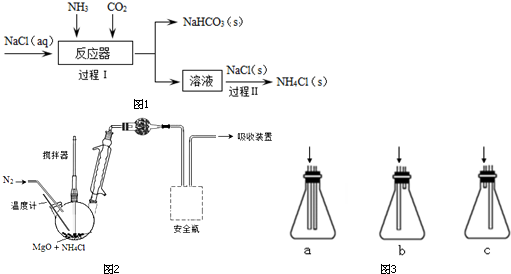
分析 (1)根据题意,碳酸氢钠加热分解生成碳酸钠,同时生成水和二氧化碳,写出反应的化学方程式即可;
(2)使溶液在碱性环境下,二氧化碳的溶解度增大;
(3)根据NH4Cl的溶解平衡可知:
(4)氨气与氯化氢相遇又结合成氯化铵;
(5)①低于300℃时,干燥管盛装的干燥剂是碱石灰;
②采用MgO循环分解NH4Cl.加热,在300℃以下获得NH3,同时生成氯化镁和水;
③氯化氢极易溶于水;
④MgO+2NH4Cl$\frac{\underline{\;300℃\;}}{\;}$ 2NH3↑+MgCl2+H2O↑,而MgCl2水解生成Mg(OH)2和HCl,MgCl2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+2HCl↑;Mg(OH)2受热生成MgO,Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O,
所以MgO可以循环应用与NH4Cl反应制得NH3和HCl.
解答 解:(1)碳酸氢钠加热分解生成碳酸钠,同时生成水和二氧化碳,反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
(2)先通NH3使溶液呈碱性,这样可增大CO2 的溶解度,产生更多的NaHCO3,
故答案为:先通NH3,后通CO2;
(3)NH4Cl的溶解平衡:NH4Cl(s)?NH4+(aq)+Cl-(aq),增大c(Cl-),平衡左移,促进氯化铵析出,
故答案为:NH4Cl(s)?NH4+(aq)+Cl-(aq),增大c(Cl-),平衡左移,促进氯化铵析出;
(4)氨气与氯化氢相遇又结合成氯化铵,NH3+HCl=NH4Cl;
故答案为:NH3+HCl=NH4Cl;
(5)①低于300℃时,干燥管盛装的干燥剂是碱石灰,
故答案为:碱石灰;
②采用MgO循环分解NH4Cl.加热,在300℃以下获得NH3,同时生成氯化镁和水:MgO+2NH4Cl $\frac{\underline{\;300℃\;}}{\;}$ 2NH3↑+MgCl2+H2O↑,
故答案为:MgO+2NH4Cl $\frac{\underline{\;300℃\;}}{\;}$ 2NH3↑+MgCl2+H2O↑
③氯化氢极易溶于水,防倒吸,选C装置,
故答案为:c;
④因为MgO+2NH4Cl$\frac{\underline{\;300℃\;}}{\;}$ 2NH3↑+MgCl2+H2O↑,而MgCl2水解生成Mg(OH)2和HCl,
MgCl2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+2HCl↑;Mg(OH)2受热生成MgO,Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O,
所以MgO可以循环应用与NH4Cl反应制得NH3和HCl.
故答案为:MgO+2NH4Cl$\frac{\underline{\;300℃\;}}{\;}$ 2NH3↑+MgCl2+H2O↑,而MgCl2水解生成Mg(OH)2和HCl,MgCl2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+2HCl↑;Mg(OH)2受热生成MgO,Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O,所以MgO可以循环应用与NH4Cl反应制得NH3和HCl.
点评 考查了物质制备方案的设计,化学实验的基本操作,题目综合性比较强,完成此题,可以依据已有的知识结合物质的性质进行.


科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 再加300mL 1 mol•L-1盐酸 | ||
| C. | 用等量铁片代替铁粉 | D. | 改用100mL 98%的硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 6:3:2 | C. | 3:1:1 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 | |
| B. | 向氯化银的悬浊液中加入氯化钠溶液,氯化银的Ksp减小 | |
| C. | 向0.0008mol•L-1的K2CrO4溶液中加入等体积0.002 mol•L-1的AgNO3溶液,则CrO42-完全沉淀 | |
| D. | 将0.001mol•L-1AgNO3溶液滴入浓度均为0.001 mol•L-1的KCl和K2CrO4混合溶液中,则先产生AgCl沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
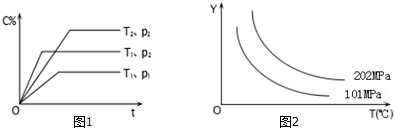
| A. | 反应物A的转化率 | B. | 平衡混合气中物质B的质量分数 | ||
| C. | 平衡混合气的密度 | D. | 平衡混合气中C的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
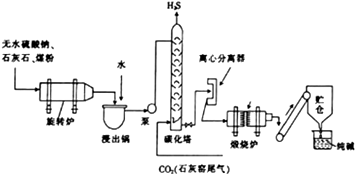 历史上路布兰法生产纯碱的工艺流程如图所示.
历史上路布兰法生产纯碱的工艺流程如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
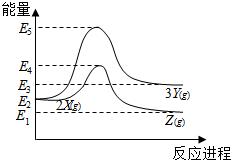
| A. | 由X→Y反应的△H=E5-E2 | B. | 由X→Z反应的△H>0 | ||
| C. | 降低压强有利于提高Y的产率 | D. | 升高温度有利于提高Z的产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别乙醇和溴苯 | |
| B. | 用红外光谱鉴别丙醛和1-丙醇 | |
| C. | 用溴水鉴别苯和正庚烷 | |
| D. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com