
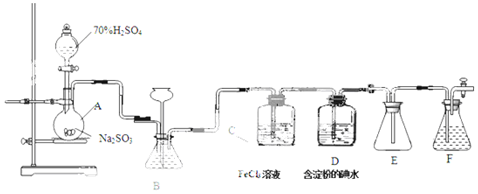
分析 A装置:制取二氧化硫,B装置:观察SO2的生成速率,C装置:SO2气体还原Fe3+,D装置:SO2气体还原I2,E装置:防止倒吸,F装置:吸收尾气.
(1)有缓冲装置能防止倒吸;二氧化硫有毒不能直接排空,应该用碱液吸收;
(2)二氧化硫能溶于水生成亚硫酸,为防止二氧化硫溶解,应该用亚硫酸氢钠溶液洗气;
(3)二氧化硫具有还原性、铁离子具有氧化性,二者发生氧化还原反应生成硫酸根离子和亚铁离子;
(4)亚铁离子和KSCN溶液不反应,但能被氯水氧化生成铁离子,铁离子和KSCN溶液反应生成血红色溶液;亚硫酸钡和稀盐酸反应,二氧化硫和亚铁离子都和酸性高锰酸钾溶液反应;
(5)同一可逆反应中,还原剂的还原性大于还原产物的还原性,根据D中溶液颜色变化判断.
解答 解:(1)E中左侧为短导管可防止液体倒吸;F中盛放NaOH溶液进行尾气处理,防止含硫化合物排放在环境中,从而保护环境,
故答案为:安全瓶,防止倒吸;NaOH;
(2)二氧化硫能溶于水生成亚硫酸,二氧化硫和亚硫酸钠、碳酸氢钠反应,为防止二氧化硫溶解,应该用亚硫酸氢钠溶液洗气,
故选C;
(3)二氧化硫具有还原性、铁离子具有氧化性,二者发生氧化还原反应生成硫酸根离子和亚铁离子,
故答案为:Fe2+、SO42-;
(4)方案①往第一份试液中加入KMnO4溶液,紫红色褪去,原来溶液中有二氧化硫,二氧化硫和亚铁离子都能被酸性高锰酸钾溶液氧化而导致酸性高锰酸钾溶液褪色,所以不能确定哪种微粒其作用,故错误;
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红,亚铁离子和KSCN不反应,铁离子和KSCN反应生成血红色溶液,所以可以检验溶液中存在亚铁离子,故正确;
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀,亚硫酸根离子和氯化钡不反应,硫酸根离子和钡离子反应生成硫酸钡沉淀,且不溶于稀盐酸,所以可以检验溶液中存在硫酸根离子,故正确;
所以实验方案①不合理,
故答案为:方案①;SO2、Fe2+都能使酸性高锰酸钾褪色;
(5)I2+SO2+2H2O=4H++2I-+SO42-中还原剂是二氧化硫、还原产物是碘离子,所以还原性SO2>I-,碘遇淀粉试液变蓝色,所以看到的现象是D中蓝色褪去,离子反应方程式为I2+SO2+2H2O=4H++2I-+SO42-,
故答案为:D中蓝色褪去;I2+SO2+2H2O=4H++2I-+SO42-.
点评 本题考查性质实验方案设计,侧重考查学生对实验方案的设计、评价,明确物质性质是解本题关键,注意(4)题为易错点,同时考查学生思维的缜密性,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:H2O>NH3>SiH4 | |
| B. | 氢元素与其他元素可形成共价化合物或离子化合物 | |
| C. |  如图所示实验可证明元素的非金属性:Cl>C>Si | |
| D. | 用中文“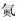 ”(ào)命名的第118号元素在周期表中位于第七周期0族 ”(ào)命名的第118号元素在周期表中位于第七周期0族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 进入煤矿井时,用火把照明 | |
| B. | 用点燃的火柴在煤气炉灶处检验是否漏气 | |
| C. | 用水浇灭钠等金属的着火 | |
| D. | 在大型庆祝活动场地,可以放充氦气的气球 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a和b都属于芳香族化合物 | |
| B. | a和c分子中所有碳原子均处于同一平面上 | |
| C. | a、b和c均能使酸性KMnO4溶液褪色 | |
| D. | b和c均能与新制的Cu(OH)2反应生成红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
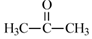 )分子中碳原子轨道的杂化类型是sp2和sp3,1mol 丙酮分子中含有σ键的数目为9NA.
)分子中碳原子轨道的杂化类型是sp2和sp3,1mol 丙酮分子中含有σ键的数目为9NA.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物中含有2个碳原子和6个氢原子 | |
| B. | 该有机物中碳和氢的原子个数比为3:1 | |
| C. | 该有机物中含有2个CO2和3个H2O | |
| D. | 该有机物的1个分子里含2个碳原子和6个氢原子,还可能含有氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
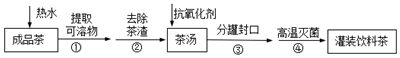
| A. | 步骤②是过滤 | |
| B. | 步骤③是分液,主要仪器是分液漏斗 | |
| C. | 步骤④高温灭菌的原理是使蛋白质细菌变性 | |
| D. | 茶多酚容易被氧化,抗氧化剂可选用维生素C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在食品袋中放入盛有硅胶的透气小袋可防止食品因氧化而变质 | |
| B. | 燃烧煤、天然气、石油等排放的大量CO2是导致雾霾产生的原因 | |
| C. | 漂白精可用作消毒剂是由于Ca(ClO)2可转化为HClO | |
| D. | 小苏打能做糕点的膨松剂是由于NaHCO3能与碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
| A. | T1>T2,且a>0 | |
| B. | 当温度为T2、反应进行到40 min时,x>0.15 | |
| C. | 温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)=0.70mol | |
| D. | 温度为T1时,达平衡时CH4 的转化率大于NO2的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com