
分析 (1)因锥形瓶下垫一张白纸使滴定终点颜色变化更明显,便于分辨;
(2)滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度,为减小误差,尖嘴部分应充满液体,无气泡;
(3)指示剂为甲基橙,变色范围为3.1-4.4;
(4)因标准液浓度变小,用量变大;
(5)根据反应消耗的硫酸,求出氢氧化钠,进一步求出样品的纯度.
解答 解:(1)因锥形瓶下垫一张白纸使滴定终点颜色变化更明显,便于分辨,
故答案为:便于准确判断终点时颜色的变化情况;
(2)滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度,为减小误差,尖嘴部分应充满液体,无气泡,
故答案为:调节到零刻度或零稍下的某一刻度;
(3)指示剂为甲基橙,变色范围为3.1-4.4,终点时pH约为4,溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色;
故答案为:3.1-4.4;溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色;
(4)因标准液浓度变小,用量变大,
故答案为:偏高;
(5)滴到消耗的硫酸为:n(硫酸)=cV=(V2-V1)×10-3L×C mol/L,根据反应方程可知,n(NaOH)=2n(硫酸)=2C(V2-V1)×10-3mol,
所以原来样品中氢氧化钠的物质的量为:2C(V2-V1)×10-3mol×$\frac{250}{25}$=2C(V2-V1)×10-2mol,则样品中氢氧化钠的质量为m(NaOH)=nM=80C(V2-V1)×10-2g,则该烧碱样品的纯度为:$\frac{80C({V}_{2}-{V}_{1})×1{0}^{-2}g}{Wg}$×100%=$\frac{0.8C({V}_{2}-{V}_{1})}{W}$×100%;
故答案为:$\frac{0.8C({V}_{2}-{V}_{1})}{W}$×100%.
点评 本题综合考查酸碱中和滴定,侧重于化学实验基本操作以及物质的含量的测定等问题,题目难度中等,建议在学习中把握相关基本实验方法,学习中注意积累.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝是地壳中含量最多的元素 | B. | 铁是人类冶炼最多的金属 | ||
| C. | 汞是所有金属中熔点最低的 | D. | 钙是人体内最多的金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
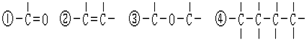
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
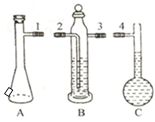 在“测定1mol气体体积”实验中,我们通常选择的测量气体是氢气,选择的反应原理是镁和稀硫酸反应.
在“测定1mol气体体积”实验中,我们通常选择的测量气体是氢气,选择的反应原理是镁和稀硫酸反应.| 实验次数 | 镁带质量(g) | 硫酸体积(mL) | C瓶读数(mL) | 抽出气体的体积(mL) |
| 1 | 0.108 | 10.0 | 129.2 | 8.0 |
| 2 | 0.105 | 10.0 | 125.7 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量为12 g | |
| B. | 体积为22.4 L | |
| C. | 二氧化碳分子个数约为6.02×1023个 | |
| D. | 氧原子个数约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打中加入过量的澄清石灰水:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| B. | 偏铝酸钠溶液中通入过量的CO2:CO2+3H2O+2AlO2-═2Al(OH)3↓+CO32- | |
| C. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O | |
| D. | Fe(NO3)2溶液中加入过量的HI溶液:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com