
| A. | 硫离子:S-2 | |
| B. | 用电子式表示氯化氢分子的形成过程: | |
| C. | 氢氧根的电子式: | |
| D. | HClO的结构式:H-O-Cl |
分析 A.元素符号有两个字母的第一个大写,第二个小写,离子符号是在元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略;
B.氯化氢是共价化合物,不存在离子键;氯原子的电子式多1个电子;
C.氢氧根中O原子与H原子之间形成1对共用电子对,用[]括起,并在右上角注明所带电荷;
D.HClO为共价化合物,分子中存在1个O-H键和1个Cl-O键,中心原子为O,结合结构式及结构简式的书写方法解答.
解答 解:A.硫离子是原子带两个负电荷的阴离子,符合为S2-,故A错误;
B.氯化氢是共价化合物,不存在离子键,氢原子与氯原子之间形成1对共用电子对,氯原子最外层有7个电子,氯化氢分子的形成过程: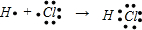 ,故B错误;
,故B错误;
C.氢氧根中O原子与H原子之间形成1对共用电子对,电子式为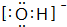 ,故C错误;
,故C错误;
D.HClO为共价化合物,分子中存在1个O-H键和1个Cl-O键,中心原子为O,结构式为H-O-Cl,故D正确;
故选D.
点评 本题考查常用化学用语的书写判断,题目难度中等,注意掌握离子符号、电子式等化学用语的概念及书写原则,明确羟基与氢氧根离子区别.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①②⑤ | C. | ②③④⑤ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变压强对该平衡的移动一定无影响 | |
| B. | 平衡体系中加入少量B,平衡向逆反应方向移动 | |
| C. | 若正反应是吸热反应,则C为非气态 | |
| D. | 若正反应是放热反应,则C为非气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的 电源.该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH) n.已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能.下列说法不正确的是( )
金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的 电源.该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH) n.已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能.下列说法不正确的是( )| A. | 采用多孔电极的目的是提高电极与电解质溶液 的接触面积,并有利于氧气扩散至电极表面 | |
| B. | M-空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne-═4M(OH)n | |
| C. | 比较 Mg、Al、Zn 三种金属-空气电池,Al-空气电池的理论比能量最高 | |
| D. | 在 Mg-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6和8 | B. | 20和17 | C. | 14和8 | D. | 6和16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1 mol•L-1盐酸和1L mol•L-1硫酸分别与1 L2 mol•L-1NaOH溶液反应速率相同 | |
| B. | 化学反应速率为0.8 mol•L-1•s-1,其含义是时间为1s时,某物质的浓度是0.8mol•L-1 | |
| C. | 0.1 mol•L-1硝酸与相同形状和大小的大理石反应的速率相同 | |
| D. | 对于任何化学反应来说,反应速率越大,反应现象就越明显 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com