
| 编号 | a的取值范围 | 产物的化学式或(离子符号) | ||||
| A | I2,Br- | |||||
| B |
| |||||
| C | ||||||
| D | I2,IO3-,Br2 | |||||
| E |
| 1mol |
| 3 |
| 1 |
| 3 |
| 1 |
| 5 |
| 6 |
| 5 |
| 1 |
| 6 |
| 1 |
| 5 |
| 1 |
| 6 |
| 1 |
| 5 |
| 6 |
| 5 |
| 1 |
| 5 |
| 6 |
| 5 |
| 编号 | a的取值范围 | 产物的化学式或(离子符号) | ||||
| A | a≤
| |||||
| B | I2、Br-、Br2 | |||||
| C | a=
| I2、Br2 | ||||
| D |
| I2、IO3-、Br2 | ||||
| E | a≥
| IO3-、Br2 |
| 1mol |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |
| 2 |
| 5 |
| 1 |
| 3 |
| 6 |
| 5 |
| 8 |
| 15 |
| 8 |
| 15 |
| 1 |
| 5 |
| 6 |
| 5 |
| 1 |
| 5 |
| 3 |
| 5 |


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
| A、铜在冷的浓硫酸中会钝化,所以把铜片放入冷的浓硫酸中无明显现象 |
| B、向FeCl2溶液中加入NaOH溶液,产生的白色沉淀在空气中马上变成红褐色 |
| C、NaOH溶液和AlCl3溶液相互滴加,现象不同 |
| D、分别 蘸有氨水和硝酸的玻璃棒相互靠近,会产生大量白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
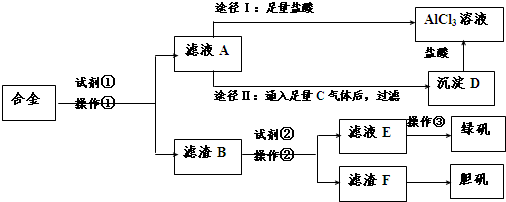
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只含Na2CO3 |
| B、只含NaHCO3 |
| C、NaOH和Na2CO3的混合物 |
| D、Na2CO3和NaHCO3的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 12 |
| 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、FeS2
| |||||||||||
B、石英砂
| |||||||||||
C、提取食盐后的母液
| |||||||||||
D、铝土矿
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ |
| B、⑤④③②① |
| C、⑤③④②① |
| D、③④⑤②① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液里滴入淀粉溶液后显蓝色 |
| B、反应时还有H2O2分解为H2O和O2 |
| C、离子方程式为:H2O2+2I-+2H+→I2+2H2O |
| D、离子方程式为:H2O2+2I-→I2+O2↑+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com