
(14分)甲醇是一种重要的可再生能源。
(1)已知2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH=a KJ/mol
CO(g)+2H2(g)=CH3OH(g) ΔH=b KJ/mol
试写出由CH4和O2制取甲醇的热化学方程式: 。
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率υ(H2)= 。

(3)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是_______。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA________PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 molCO和20 molH2,则在平衡状态B时容器的体积V(B)= L。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。
①若KOH溶液足量,则写出电池总反应的离子方程式:___________________。
②若电解质溶液中KOH的物质的量为0.8 mol,当有0.5 mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是 。
科目:高中化学 来源:2014-2015学年安徽省“江淮十校”高三4月联考理综化学试卷(解析版) 题型:推断题
麻黄素是一种拟肾上腺素药,主要用于治疗习惯性支气管哮喘等,其合成路线如下:(有些反应物省略)
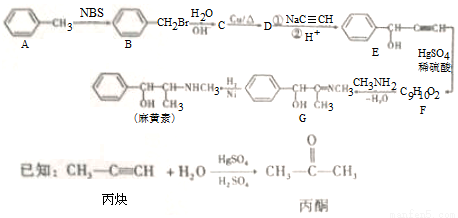
(1)A到B的反应类型是________。
(2)E中官能团名称为________。
(3)D与银氨溶液反应的化学方程式为________。
(4)F的结构简式是_____,H是F的同分异构体,H中含有苯环,苯环上只有两个取代基,并且能发生水解反应,则H的可能结构有_______种,其中核磁共振氢谱显示有四组峰的结构简式为(任写~种)_______。
(5)下列关于G的说法正确的是________。
a.能发生加成反应
b.能发生酯化反应
c.能使酸性高锰酸钾溶液褪色
d.能与盐酸反应
e.能发生消去反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在水溶液中能大量共存的是
A.NH4+、Ag+、CO32—、SO42— B.Fe2+、H+、NO3—、Cl-
C.Al3+、NH4+、HCO3—、Cl- D.K+、Na+、NO3—、SO42—
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通、扬州、连云港高三第二次调研测试化学试卷(解析版) 题型:选择题
国务院颁布的《“十二五”控制温室气体排放工作方案》提出,2015年我国单位国内生产总值CO2排放要比2010年下降17 %。下列说法不正确的是
A.CO2属于酸性氧化物
B.CO2是导致酸雨发生的主要原因
C.可用Na2CO3溶液捕捉(吸收)CO2
D.使用氢能源替代化石燃料可减少CO2排放
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省长春市高三质量监测三理综化学试卷(解析版) 题型:选择题
下列有关物质的实验操作、现象及结论描述正确的是
选项 | 实验操作及现象 | 结论 |
A | 用铂丝蘸取某待测液在酒精灯外焰上灼烧,火焰呈紫色(透过蓝色钴玻璃) | 待测试液中一定含有钾元素,可能含钠元素 |
B | 向某无色溶液中通入过量的CO2气体,有白色沉淀产生 | 该溶液中一定含有SiO32– |
C | 向品红溶液中通入某气体后,溶液褪色 | 该气体一定是SO2 |
D | 向NaOH溶液中滴加MgCl2溶液,产生白色沉淀,继续滴加FeCl3溶液产生红褐色沉淀 | Fe(OH)3的溶解度大于Mg(OH)2的溶解度 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三四月调研考试理综化学试卷(解析版) 题型:填空题
(14分)煤可以通过气化和液化转变为清洁能源并提高燃烧效率。
煤气化的主要反应是:C(g)+ H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
气化得到的CO和H2可以进一步液化合成甲醇,反应方程式为:
CO(g)+2H2(g) CH3OH(g) H
CH3OH(g) H
(1)若相同温度下CO、H2、CH3OH(g)的燃烧热(H)分别为a、b、c,则上述反应的H= 。
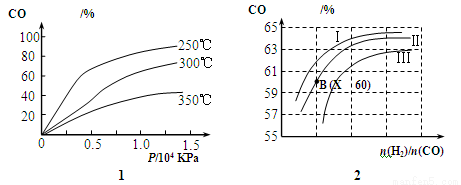
(2)图1表示CO的转化率与温度、压强之间的关系,图2表示CO的转化率与起始投料比n(H2)/n(CO)、温度的变化关系,曲线I、Ⅱ、Ⅲ对应的温度分别为T1、T2、T3,则T1、T2、T3的大小关系为 ,理由 。测得B(X,60)点氢气的转化率为40%,则X= 。
(3)一定条件下,将2 mol CO和4 mol H2置于容积为2 L固定的密闭容器中发生上述反应,反应达到平衡时H2的物质的量为2 mol,则此时CH3OH(g)的物质的量浓度为 ,平衡常数K= 。下列说法中能说明反应已达到平衡状态的是 (填选项前的字母)。
A.混合气体的平均摩尔质量不变
B.一氧化碳的消耗速率等于甲醇的生成速率
C.CO和H2的物质的量之比保持不变
D.混合气体的密度不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是
选项 | 条件 | 离子组 | 离子共存判断及离子方程式 |
A | 滴加氨水 | Na+、Al3+、Cl—、NO3— | 不能大量共存,Al3++3OH—=Al(OH)3↓ |
B | 由水电离出的c(H+) =1×10—13mol/L | K+、NH4+、Cl—、AlO2— | 能大量共存 |
C | pH=1的溶液 | Fe3+、NH4+、I—、SO42— | 不能大量共存, 2Fe3++2I—=2Fe2++I2 |
D | 通入少量SO2气体 | K+、Na+、ClO—、SO42— | 不能大量共存,2ClO—+ SO2+H2O=2HClO+ SO32— |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高三第二次模拟考试理综化学试卷(解析版) 题型:简答题
(14分)如下表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(1)③、④、⑦的原子半径由大到小的顺序为 (用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 (用酸的化学式表示)。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 ;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
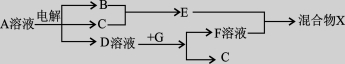
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法 。
③常温下,若电解1L0.1 mol·L-1的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 。
④写出过量的E与F溶液中溶质反应的离子方程式 。
(5)由②、④、⑥元素组成的化合物W(在酸性溶液中发黄,W还原性较强),在溶液中易被⑦的单质氧化,该反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com