
| A. | 电解铝时阴极材料需要定期更换 | |
| B. | 炼钢中添加硅、锰、铝等作为脱氧剂,调整钢水的成分,制成多种性能优良的钢材 | |
| C. | 炼钢主要目的是在高温下用还原剂将过多的碳和其他杂质还原成气体或炉渣除去 | |
| D. | 工业上一般以铁矿石、焦炭、石灰石和空气等原料在高炉中冶炼生铁 |
分析 A.阴极铝离子得电子还原生成铝,石墨不参与反应;
B.炼钢中添加硅、锰、铝等作为脱氧剂,调整钢水的成分,制成多种性能优良的钢材;
C.炼钢主要目的是在高温下用氧化剂将过多的碳和其他杂质还原成气体或炉渣除去;
D.焦炭与氧气反应生成一氧化碳,同时放出大量热,一氧化碳具有还原性,在高温下和氧化铁反应生成铁和二氧化碳.
解答 解:A.电解铝时阴极材石墨不参与反应,电极质量不变,故A错误;
B.炼钢中添加硅、锰、铝等作为脱氧剂,调整钢水的成分,制成多种性能优良的钢材,故B正确;
C.炼钢主要目的是在高温下用氧化剂将过多的碳和其他杂质还原成气体或炉渣除去,故C错误;
D.焦炭与氧气反应生成一氧化碳,同时放出大量热,一氧化碳具有还原性,在高温下和氧化铁反应生成铁和二氧化碳,所以工业上一般以铁矿石、焦炭、石灰石和空气等原料在高炉中冶炼生铁,故D正确;
故选:BD.
点评 本题考查了金属冶炼的原理,掌握常见金属的冶炼原理是解题的关键,题目较简单.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 同质量、同密度的O2和NO | B. | 同质量、不同密度的NO和C2H6 | ||
| C. | 同体积、同压强的CO和C2H4 | D. | 同温度、同体积的N2和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
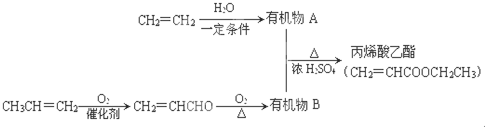
 ,丙烯酸乙酯分子中的含氧官能团名称是碳碳双键、酯基.
,丙烯酸乙酯分子中的含氧官能团名称是碳碳双键、酯基. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将磁性氧化铁溶于稀硫酸:Fe3O4+8H+=3Fe3++4H2O | |
| B. | 0.2mol明矾与300mL1mol/L的氢氧化钡溶液混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO3-=Fe3++2H2O+NO↑ | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L水中所含原子总数为3NA | |
| B. | 常温常压下,44 gC3H8中含有的碳碳单键数为3NA | |
| C. | 标准状况下,44.8 L NO与22.4L O2混合后,气体分子总数为3NA | |
| D. | 1 molNa2O和Na2O2混合物中含有的阴.阳离子总数是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3的分解率为20% | B. | 10分钟内ν(SO2)=0.01mol/(L•min) | ||
| C. | 容器内气体的密度为40g/L | D. | 此温度下反应①的平衡常数为4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com