
盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂.请回答下列问题:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有________性.用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有________性.
(2)①在100 mL 18 mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是________.
A.40.32 L
B.30.24 L
C.20.16 L
D.13.44 L
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式________.
(3)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水.该反应的化学方程式为________.
(4)分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出溶液呈“绿色”可能是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否(简述实验方案和实验现象及由此得出的结论)________.
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
| 空气 |
| △ |
| HNO3(稀) |
查看答案和解析>>
科目:高中化学 来源:2012届湖南省衡阳市八中高三第三次月考化学试卷(解析版) 题型:实验题
(12分)盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有 性。用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有  性。
性。
(2)①在100mL 18mol·L—1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 。
| A.40.32L | B.30.24L | C.20.16L | D.13.44L |
 应的化学方程式为 。
应的化学方程式为 。查看答案和解析>>
科目:高中化学 来源:2013届湖南省衡阳八中高三第三次教育质量检测化学试卷(带解析) 题型:填空题
(14分)盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有 性。用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有 性。
(2)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是 (填序号)。
① Cu + HNO3(浓)→ Cu(NO3)2 ② Cu + HNO3(稀)→ Cu(NO3)2
③ Cu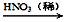 CuO
CuO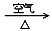 Cu(NO3)2
Cu(NO3)2
(3)①在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,测得产生的气体在标准状况下的体积可能是 。
| A.40.32L | B.30.24L | C.20.16L | D.13.44L |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省高三上学期第三次统练理综化学试卷(解析版) 题型:填空题
盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:

(1) 常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有 性,用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有 性,实验室不能用浓硫酸干燥氨气,说明硫酸具有 性。
(2) 硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。右图所示制备方法符合“绿色化学”思想的
是 (填序号)。
(3) ①在100ml 18 mol/L浓硫酸中加入过量铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 。
A.40.32 L B.30.24 L C.20.16 L D.13.44 L
②若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式 。
(4) 某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水,则反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省武汉市四校高三10月联考化学试卷(解析版) 题型:填空题
(10分)盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有 性。用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有 性。
(2)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是 (填序号)。
① Cu + HNO3(浓)→ Cu(NO3)2 ② Cu + HNO3(稀)→ Cu(NO3)2
③ Cu 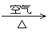 CuO
CuO
 Cu(NO3)2
Cu(NO3)2
(3)①在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,测得产生的气体在标准状况下的体积可能是 。
A.40.32L B.30.24L C.20.16L D.13.44L
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式 。
(4)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com