
某溶液中Cl-、Br-、I-三者物质的量之比是1:2:3,通入一定量的Cl2,当反应完全后,该比值变为3:2:1,则反应的Cl2和原溶液中I-的物质的量之比是( )
A.1:2 B.1:3 C.1:4 D.1:6
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源:2015届福建省高三上学期第二次质量检查化学试卷(解析版) 题型:实验题
(15分)I2O5是白色固体,遇水生成碘酸(HIO3)。I2O5可用于检验并定量测定空气中的CO,在常温下发生的反应为 5CO+I2O5=5CO2+I2 (空气中其余气体不与I2O5反应)。
实验一:制取I2O5
将碘酸加热至90~110 ?C使其部分脱水,再升温至220~240 ℃并恒温4 h,使反应完全。接着慢慢冷却至室温,密封保存,即得五氧化二碘。
(1)写出碘酸制I2O5的化学方程式: 。
(2)在制得的I2O5固体中含有少量I2杂质,提纯的方法是 (填标号);
A.过滤 B.蒸发结晶 C.蒸馏 D.升华
用提纯方法用到的玻璃仪器为 (填标号)。
A.圆底烧瓶 B.烧杯 C.普通漏斗 D.酒精灯 E.玻璃棒
实验二:检验空气中CO
利用下图装置检验空气中是否存在CO。
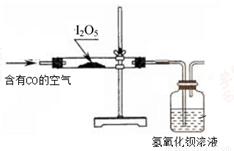
(3)能说明空气中含有CO的现象是 。
(4)倘若要从广口瓶中出现浑浊来判断空气中含有CO,请写出改进的实验方案: 。
实验三:测定空气中CO的含量
(5)将I2O5与CO反应生成的碘单质用硫代硫酸钠滴定(反应为I2+2Na2S2O3=Na2S4O6+2NaI),即可根据消耗硫代硫酸钠的量来计算空气中CO的含量。若某次实验时测得参与反应的空气体积为a mL(标准状况下),滴定过程中,共消耗v mL c mol·L-1 Na2S2O3溶液。则该空气样品中CO的体积分数是 。
(6)该实验测定出来的结果不可信,最大可能的原因是: 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省福州市高三上学期第三次质检理综化学试卷(解析版) 题型:填空题
(15分)电石是重要的工业原料,电石渣[主要成分Ca(OH)2]的综合利用体现了绿色化学思想。
(1)用电石为原料可生产聚氯乙烯。聚氯乙烯的结构简式为____________。
(2)电石渣可用于除去垃圾焚烧炉烟道气中的SO2生成CaSO4,反应中的氧化剂是____________(填名称)。
(3)电石渣可用于生产纯碱。涉及的部分化学反应为:
(i)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(ii)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
此生产过程中,可循环利用的物质有____________(填化学式)。
(4)用电石渣处理酸性含铬(Cr2O72—)电镀废水的流程如下:

①步骤(i)发生反应的化学方程式为__________________
②步骤(ii)发生反应的离子方程式为__________________
③步骤(iii)调节溶液pH为8,则残留Cr3+的浓度为___(Ksp[Cr(OH)3]=6.3×10—31)。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
对于反应KClO3+ HCl = KC1 + Cl2 ↑+ H2O(未配平)若有0.1 mol KClO3 参加反应,下列说法正确的是 ( )
A.转移0.5 mol电子 B.生成0.1 mol Cl2
C.被氧化的HC1为0.6 mol D.Cl2是只是氧化产物不是还原产物
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
下列实验现象的描述正确的是
A.氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白色烟雾
B.氧化铁溶于水生成红褐色沉淀
C.铜在氯气中燃烧,产生棕黄色烟
D.钠在空气中燃烧,发出黄色的火焰,生成白色固体
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
市场上销售的“84”消毒液,其商品标识上有如下叙述:①本品为无色液体,呈碱性②使用时加水稀释③可对餐具、衣物进行消毒,可漂白浅色衣物。其有效成分可能是( )
A.Cl2 B.SO2 C.NaClO D.KMn04
查看答案和解析>>
科目:高中化学 来源:2015届福建省、安溪一中高三上学期期中联考化学试卷(解析版) 题型:填空题
(16分)X、Y、Z、W四种常见元素,且均为短周期元素。
已知:①X的最高价氧化物对应的水化物为无机酸中最强酸
②Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料
③Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料
④W被称为军事金属,可在CO2中燃烧。
(1)X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为 。
(2)Z的氧化物在通讯领域用来作 ,工业上制Z单质的化学反应方程式为 。
(3)在50mL ,lmol·L-1的YX3溶液中逐滴加入0.5mol·L-1的NaOH溶液,得到1.56g沉淀,则加入NaOH溶液的体积最多为 mL。
(4)Y、W合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某Y、W合金(设不含其他元素)中W的质量分数,设计下列三种不同的实验方案进行探究。填写下列空白:
[探究一]
实验方案:Y、W合金 测定剩余固体质量
测定剩余固体质量
实验步骤:
①称取一定质量的Y、W合金粉末样品,加入过量的Na0H溶液,充分反应。实验中发生反应的化学方程式是 。
②过滤、洗涤、干燥、称量剩余固体。若未洗涤固体,将导致测得的W的质量分数
(填“偏高”或“偏低”)。
[探究二]
实验方案:称量xg Y、W合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。

问题讨论:
③欲计算W的质量分数。该实验中还需测定的数据是 。
④若用空气代替O2进行实验,对测定结果是否有影响? (填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源:2015届福建省、安溪一中高三上学期期中联考化学试卷(解析版) 题型:选择题
下列关于钠及其化合物的说法正确的是
①钠钾合金通常状况下呈液态,可做原子反应堆的导热剂
②钠的化学性质活泼,少量的钠可保存在有机溶剂CH3CH2OH中
③钠在空气中缓慢氧化生成Na2O,在氧气中剧烈燃烧而生成Na2O2
④由于钠比较活泼,所以它能从CuSO4溶液中置换出金属Cu
⑤过氧化钠在某些呼吸面具中用于制备氧气
⑥Na2CO3溶液能跟酸溶液反应,但不能跟任何碱溶液反应
A.①③⑥ B.②③④ C.①④⑥ D.①③⑤
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中质量检测化学试卷(解析版) 题型:选择题
下列描述中,不符合生产实际的是
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,可用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com