
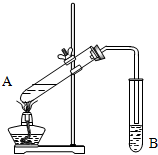
 实验室用如图所示装置制取乙酸乙酯.
实验室用如图所示装置制取乙酸乙酯. CH3COOC2H5+H2O,
CH3COOC2H5+H2O, CH3COOC2H5+H2O;
CH3COOC2H5+H2O;

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
 铈、铬、钴、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.
铈、铬、钴、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.| 放电 |
| 充电 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| T/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 硫酸铜/g | 14.8 | 20.5 | 28.5 | 39.6 | 53.6 | 73.0 |
| 硝酸铜/g | 83.5 | 125.0 | 163.0 | 182.0 | 208.0 | 247.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1升溶液中所含阴、阳离子总数是0.6NA |
| B、1升溶液中含有0.2NA个NO3-离子 |
| C、500毫升溶液中的Ba2+离子浓度是0.2mol/L |
| D、500毫升溶液中的NO3-离子浓度是0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饮用水可以用明矾、漂白粉来净化,两者的作用原理相同 |
| B、常温常压下,78gNa2O2固体中所含阴离子数一定为NA |
| C、NH4Cl、MgCl2均为离子化合物,均含有离子键和共价键 |
| D、实验室中浓硝酸保存在带橡胶塞的棕色细口试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com