
| A. | NaH、NH3都属于共价化合物 | B. | 12C、C60都属于碳的同素异形体 | ||
| C. | 水玻璃、硅酸都属于胶体 | D. | 生铁、青铜都属于合金 |
分析 A.活泼金属与活泼非金属形成离子键;
B.同种元素的不同单质互为同素异形体;
C.水玻璃是硅酸钠溶液;
D.合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质.
解答 解:A.活泼金属与活泼非金属形成离子键,NaH中含有离子键属于离子化合物,NH3属于共价化合物,故A错误;
B.同种元素的不同单质互为同素异形体,12C是原子不是单质,故B错误;
C.水玻璃是硅酸钠溶液,不是胶体,硅酸是胶体,故C错误;
D.合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质,则生铁、青铜都属于合金,故D正确.
故选D.
点评 本题考查了离子化合物和共价化合物、同素异形体的概念、胶体的辨析、合金,侧重于基础知识的考查,题目难度不大,注意基础知识的积累.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| B. | 碘是人体必需微量元素,所以要多吃富含高碘酸的食物 | |
| C. | 药皂中含有苯酚,能杀菌消毒,故苯酚具有强氧化性 | |
| D. | 屠呦呦获得了2015年诺贝尔奖,她用乙醚提取青蒿素的过程属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
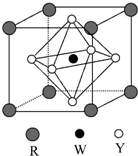 前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与氩原子相同;R原子的d轨道上有3个空轨道.请回答下列问题:
前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与氩原子相同;R原子的d轨道上有3个空轨道.请回答下列问题: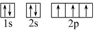 ,R基态原子的价层电子排布式为3d24s2.
,R基态原子的价层电子排布式为3d24s2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 硝酸亚铁溶液中滴加少量稀硫酸:Fe2++NO3-+4H+═Fe3++NO↑+2H2O | |
| C. | 把反应Cu+2FeCl3═2FeCl2+CuCl2设计成原电池,其正极反应为Fe3++e-═Fe2+ | |
| D. | 向硫酸氢钠溶液中加入氢氧化钡溶液至中性,则离子方程式为H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
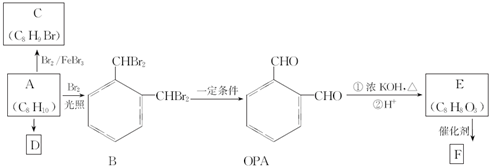
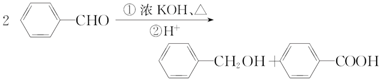
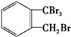 .
.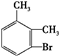 、
、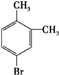 .
.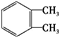 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$ $→_{△}^{CH_{3}CH_{2}OH、浓硫酸}$
$→_{△}^{CH_{3}CH_{2}OH、浓硫酸}$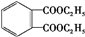 .
.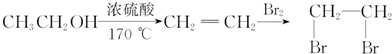
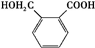 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$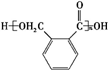 +(n-1)H2O.
+(n-1)H2O.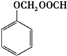 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
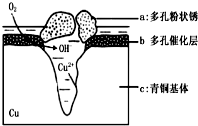 青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2 ( OH )3 Cl.下列说法不正确的是( )
青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2 ( OH )3 Cl.下列说法不正确的是( )| A. | 腐蚀过程中,负极 b 被氧化 | |
| B. | 环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ | |
| C. | 若生成 2.145gCu 2 ( OH ) 3 Cl,则理论上消耗标准状况氧气体积为 0.448L | |
| D. | 正极的电极反应式为:正极反应是 O2+4e-+2H2O=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
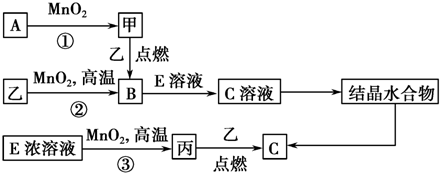
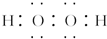 .若反应①需在加热条件下进行,则反应①的化学方程式为2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑.
.若反应①需在加热条件下进行,则反应①的化学方程式为2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com