
实验室常用强氧化剂(如KMnO4、KClO3、MnO2等)氧化浓盐酸的方法来制备氯气,某研究性学习小组欲探究用Na2O2与浓盐酸制备并检验氯气。供选用的实验试剂及装置如下图所示(部分导管、蒸馏水略)。
a.Na2O2 b.浓盐酸 c.碱石灰 d.NaOH溶液 e.淀粉KI溶液 f.CaCO3 g.石蕊溶液 h.饱和NaCl溶液
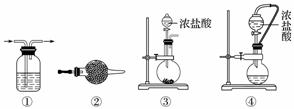
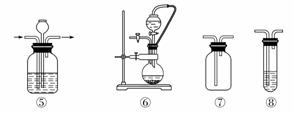
(1)写出用Na2O2与浓盐酸制备氯气的化学方程式:______________。
(2)下表中的装置组合最合理的是__________(填字母,需考虑实验结束撤除装置时残留有害气体的处理)。
| 组合 | 制备装置 | 净化装置 | 检验装置/试剂 | 尾气处理装置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③⑥ | ① | ⑧/g | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ⑥ | ⑤ | ⑧/g | ① |
(3)尾气经处理后仍有较多气体排出,其主要原因可用化学方程式表示为________________________________________________________________________。
(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
①________________________________________________________________________;
②________________________________________________________________________
答案 (1)Na2O2+4HCl(浓)===2NaCl+Cl2↑+2H2O
(2)D
(3)2Na2O2+2H2O===4NaOH+O2↑(或2Na2O2+4HCl===4NaCl+2H2O+O2↑)
(4)①Na2O2能与水反应,会使原料的利用率降低 ②双氧水比Na2O2更经济 ③产生等量的Cl2,用双氧水消耗盐酸的量少 ④Na2O2能与水反应,生成的NaOH能与盐酸反应 ⑤Na2O2能与水反应,生成的NaOH吸收了Cl2(填写其中任意两条即可)
解析 Na2O2具有强氧化性,能把Cl-氧化成Cl2,制备时应把浓盐酸滴到Na2O2固体上,所以应选⑥作为制备装置,装置⑤可观察导气管是否堵塞,利用KI淀粉溶液或石蕊溶液检验Cl2,根据装置应选择⑧/g,可用NaOH溶液吸收Cl2。在此实验中,不可避免Na2O2和水反应生成O2。


科目:高中化学 来源: 题型:
下列说法错误的是( )
A.用聚乙烯塑料代替聚乳酸塑料可减少白色污染(2014·天津理综,1B)
B.大量燃烧化石燃料是造成雾霾天气的一种重要因素(2014·天津理综,1C)
C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底(2014·天津理综,3C)
D.乙烯可作水果的催熟剂(2014·四川理综,1A)
查看答案和解析>>
科目:高中化学 来源: 题型:
①②(3)](2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为________。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为________(填化学式)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上可用亚氯酸钠和稀盐酸为原料制备ClO2,反应如下:
NaClO2+HCl—→ClO2↑+________(没有配平)
(1)上述方程式中,缺项物质是________,配平方程式,并在下面补全反应物系数。
 NaClO2+
NaClO2+ HCl—→
HCl—→
(2)该反应中氧化剂和还原剂的物质的量之比是________________________________________________________________________。
生成0.2 mol ClO2转移电子的物质的量为________ mol。
(3)ClO2对污水中的Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某污水中含CN- a mg·L-1,现用ClO2将CN-氧化,只生成两种无毒气体。处理100 m3这种污水,至少需要ClO2________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量的氧化铁杂质。具体实验流程如下:
明矾石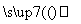


请回答下列问题:
(1)操作1所用到的玻璃仪器的名称是____________。
(2)由溶液3制取氢氧化铝的离子方程式为__________________________。
(3)明矾石焙烧时产生SO2,请你写出能验证SO2具有还原性且实验现象明显的化学方程式:______________。
(4)请你写出验证溶液1中有NH 的实验过程:________________________。
的实验过程:________________________。
(5)实验室用Fe2O3与CO反应来制取单质Fe。
①请按气流由左到右的方向连接下列各装置,顺序为A→________。
②检查装置A气密性的方法是________________________________________________________________________。
③在点燃B处的酒精灯前,应进行的操作是__________________。
④装置C的作用是________________。

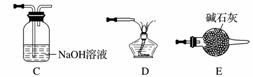
查看答案和解析>>
科目:高中化学 来源: 题型:
对比以下几个反应式:
Cl+Cl―→Cl2,ΔH=-247 kJ·mol-1;
O+O―→O2,ΔH=-493 kJ·mol-1;
N+N―→N2,ΔH=-946 kJ·mol-1。
可以得出的结论是( )
A.在常温下氮气比氧气和氯气稳定
B.氮、氧和氯的单质常温下为气体
C.氮、氧和氯都是双原子分子
D.氮气、氧气和氯气的密度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各说法中正确的是( )
A.分子中键能越大,键长越长,则分子越稳定
B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子间不能形成共价键
C.水分子可表示为H—O—H,分子中键角为180°
D.H—O键键能为463 kJ·mol-1,即18克H2O分解成H2和O2时,消耗能量为2×463 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5 mol·L-1 MgSO4溶液和0.5 mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
回答下列问题:
①步骤3中加氨水后的离子方程式_____________________________________________。
②步骤4为加快过滤速度,常用_________________________________________________(填过滤方法)。
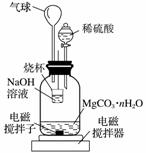
(2)测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶须,放入右图所示的广口瓶中,加入适量水,滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,反应后期将温度升到30 ℃,最后的烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。
①图中气球的作用是______________________________________________________
__________________________;
②上述反应后期要升温到30 ℃,主要目的是__________________________________;
③设3次实验测得每1.000 g碳酸镁晶须产生的CO2平均值为a mol,则n值为________________________(用含a的表达式表示)。
(3)称取100 g上述晶须产品进行热重分析,热重曲线如下图。则该条件下合成的晶须中,n=____________(选填:1、2、3、4、5)。

查看答案和解析>>
科目:高中化学 来源: 题型:
现将氯化铝溶液蒸干灼烧并熔融后用铂电极进行电解,下列有关电极产物的判断正确的是( )
A.阴极产物是氢气
B.阳极产物是氧气
C.阴极产物是铝和氧气
D.阳极产物只有氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com