
| A. | 铜片质量减少 | B. | 石墨棒质量增加 | C. | 电流表指针偏转 | D. | 溶液显蓝色 |
分析 铜、石墨和硫酸铁溶液符合原电池的构成条件,活泼金属铜易失电子发生氧化反应而作负极,电极反应式为:Cu-2e-=Cu 2+,石墨作正极,正极上铁离子得电子发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+,由此分析解答.
解答 解:铜、石墨和硫酸铁溶液符合原电池的构成条件,活泼金属铜易失电子发生氧化反应而作负极,电极反应式为:Cu-2e-=Cu 2+,石墨作正极,正极上铁离子得电子发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+,
A、金属铜易失电子发生氧化反应而作负极,电极反应式为:Cu-2e-=Cu 2+,所以铜的质量减少,故A正确;
B、石墨作正极,正极上铁离子得电子发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+,电极本身质量不变,故B错误;
C、化学能转化为电能,外电路有电子的转移,所以电流表指针偏转,故C正确;
D、活泼金属铜易失电子发生氧化反应而作负极,电极反应式为:Cu-2e-=Cu 2+,所以溶液显蓝色,故D正确;
故选B.
点评 本题考查了原电池原理,明确原电池构成条件是解本题关键,注意铜和铁离子能自发发生氧化还原反应,符合构成原电池的条件.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A. | 金属性:甲>乙>丁 原子半径:己>辛>戊 | |
| B. | 辛是金属元素,元素符号为Ge | |
| C. | 丙与庚的原子核外电子数相差13 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2、NO和O2三者共存 | |
| B. | 单位时间内生成n molO2的同时生成2n mol NO | |
| C. | 容器中颜色不再变化 | |
| D. | 容器中NO2、NO、O2的物质的量浓度之比为2:2:1的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6个碳原子有可能都在一条直线上 | |
| B. | 分子中最多有12个原子在同一平面上 | |
| C. | 6个碳原子有可能都在同一平面上 | |
| D. | 6个碳原子不可能都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图Ⅰ研究的是t0时升高温度对反应速率的影响 | |
| B. | 图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 | |
| C. | 图Ⅲ研究的是压强对化学平衡的影响,且乙压强大于甲 | |
| D. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
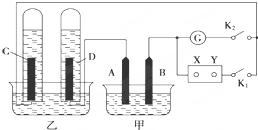 在图均用石墨作电极的电解池中,甲装置中为500mL含某一溶质的蓝色溶液,乙装置中为500mL稀硫酸.闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重6.4g.
在图均用石墨作电极的电解池中,甲装置中为500mL含某一溶质的蓝色溶液,乙装置中为500mL稀硫酸.闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重6.4g.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 实验结论 |
| A | 向某工业废水中加入过量浓溴水 | 产生白色沉淀 | 该废水中可能含有苯酚 |
| B | 向溴乙烷中滴加硝酸银溶液 | 产生浅黄色沉淀 | 溴乙烷中含有溴元素 |
| C | 某有机物中加入金属Na | 产生气泡 | 该物质为乙醇 |
| D | 乙醇与浓硫酸共热,将产生的气体通入溴水中 | 溴水褪色 | 该气体一定为乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+,Na+,NO3-,Cl- | B. | K+,Na+,NO3-,Cl- | ||
| C. | K+,Na+,Cl-,AlO2- | D. | K+,NH4+,SO42-,NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com