
【题目】利用钛白工业的副产品FeSO4[含Al2(SO4)3和少量重金属离子],可以生产电池级高纯超微细草酸亚铁.其工艺流程如图1: 
已知:①5Fe2++MnO ![]() +8H+═5Fe3++Mn2++4H2O
+8H+═5Fe3++Mn2++4H2O
②5C2O42﹣+2MnO ![]() +16H+═10CO2↑+2Mn2++8H2O
+16H+═10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 .
(2)滤液Ⅱ经处理可得到副产品 .
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25mL 2molL﹣1的H2SO4溶解.
步骤2:用0.2000molL﹣1标准KMnO4溶液滴定,消耗其体积30.40mL.
步骤3:向滴定后的溶液中加入2g Zn粉和5mL 2molL﹣1的H2SO4溶液,将Fe3+还原为Fe2+ .
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.40mL.
则样品中C2O42﹣的物质的量为 .
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图2,产生这种变化趋势的原因可能为
【答案】
(1)NH3?H2O受热易分解,挥发出NH3 , Fe(OH)2受热也易分解
(2)(NH4)2SO4
(3)0.01mol
(4)生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快
【解析】解:(1)沉淀过程为一水合氨沉淀亚铁离子的过程,生成氢氧化亚铁,氢氧化亚铁不稳定,受热会分解,另外一水合氨受热也会分解,故反应温度不能太高,所以温度不宜过高的原因除了控制沉淀的粒径外,还有NH3H2O受热易分解,挥发出NH3 , Fe(OH)2受热易分解;
故答案为:NH3H2O受热易分解,挥发出NH3 , Fe(OH)2受热也易分解;(2)沉淀前的溶液中含有硫酸亚铁,沉淀步骤中加入一水合氨,生成氢氧化亚铁沉淀和硫酸铵,所以副产品含有是(NH4)2SO4;
故答案为:(NH4)2SO4;(3)由题意知氧化C2O42﹣和Fe2+共消耗0.2000 molL﹣1标准KMnO4溶液体积30.40 mL,步骤3、4标准KMnO4溶液只氧化Fe2+消耗KMnO4溶液体积10.40mL,所以C2O42﹣消耗KMnO4溶液体积为(30.40﹣10.40)=20mL,由5C2O42﹣+2MnO4﹣+16H+=10CO2↑+2Mn2++8H2O得5C2O42﹣~2MnO4﹣ , 所以n(C2O42﹣)= ![]() n(MnO4﹣)=20ml×10﹣3×0.2000molL﹣1×
n(MnO4﹣)=20ml×10﹣3×0.2000molL﹣1× ![]() =0.01mol;
=0.01mol;
故答案为:0.01mol;(4)从图象上观察,随着反应对进行,曲线的斜率越来越大,说明单位时间内Mn2+的浓度越来越大,所以反应速率越来越快,反应中温度不变,随着反应的进行,反应物的浓度变小,而反应速率加快,只能是生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快;
故答案为:生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快.
副产品FeSO4(含Al(SO4)3和少量重金属离子)中加入铁粉,将少量重金属离子等除去,得到比较纯净的FeSO4溶液,向FeSO4溶液中加入氨水,生成氢氧化亚铁,氢氧化亚铁和草酸反应生成高纯超微细草酸亚铁沉淀;(1)温度不宜过高的原因除了控制沉淀的粒径外,还有NH3H2O受热易分解,挥发出NH3 , Fe(OH)2受热易分解;(2)沉淀前的溶液中含有硫酸亚铁,沉淀步骤中加入一水合氨,生成氢氧化亚铁沉淀和硫酸铵;(3)由题意知氧化C2O42﹣和Fe2+共消耗0.2000 molL﹣1标准KMnO4溶液体积30.40 mL,步骤3、4标准KMnO4溶液只氧化Fe2+消耗KMnO4溶液体积10.00mL,所以C2O42﹣消耗KMnO4溶液体积为(30.40﹣10.00)=20.4mL,由5C2O42﹣+2MnO4﹣+16H+=10CO2↑+2Mn2++8H2O得5C2O42﹣~2MnO4﹣ , 依据多步反应找关系式计算;(4)观察图象分析反应速率变大的因素,随着反应对进行,曲线的斜率越来越大,说明单位时间内Mn2+的浓度越来越大,所以反应速率越来越快,反应中温度不变,随着反应的进行,反应物的浓度变小,而反应速率加快,只能是生成的Mn2+作催化剂.


科目:高中化学 来源: 题型:
【题目】(1)由下图所示A、B、C三种仪器:请选择下列仪器名称的序号,填入相应的空格内:①烧杯,②普通漏斗,③圆底烧瓶,④锥形瓶,⑤分液漏斗。
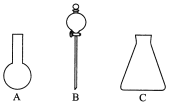
A________,B________,C________。
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如下图所示。由图中可以看出,该同学在操作时的一个错误是______________________________,烧杯的实际质量为________g。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
P4(白磷,s)+5O2(g)═P4O10(s)△H=﹣2983.2kJ/mol
P(红磷,s)+ ![]() O2(g)═
O2(g)═ ![]() P4O10(s)△H=﹣738.5kJ/mol
P4O10(s)△H=﹣738.5kJ/mol
试写出白磷转化为红磷的热化学方程式;白磷的稳定性比红磷(填“高”或“低”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图甲所示为二维平面晶体示意图,化学式表示为AX3的是________。
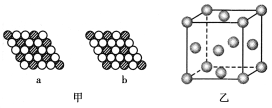
(2)图乙为一个金属铜的晶胞,请完成以下各题:
①该晶胞“实际”拥有的铜原子数是________个;
②该晶胞称为________(填序号);
A.六方晶胞 B.体心立方晶胞 C.面心立方晶胞
③此晶胞立方体的边长为a cm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数为________(用aρ表示)。
(3)《X射线金相学》中记载关于铜与金可形成两种有序的金属互化物,其结构如下图所示。下列有关说法正确的是________。
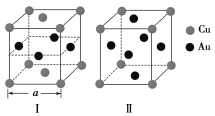
A.图Ⅰ、Ⅱ中物质的化学式相同
B.图Ⅱ中物质的化学式为CuAu3
C.图Ⅱ中与每个铜原子紧邻的铜原子有3个
D.设图Ⅰ中晶胞的边长为a cm,则图Ⅰ中合金的密度为![]() g·cm-3
g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某蛋白质分子的结构示意图,图中α链由21个氨基酸组成,β链由19个氨基酸组成,图中“-S-S-”是在蛋白质加工过程中由两个“-SH”脱下2个H形成的。下列有关叙述中,错误的是( )
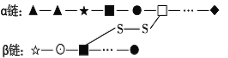
A.蛋白质多样性的原因包括氨基酸的排列顺序不同
B.该蛋白质含有40种氨基酸
C.该蛋白质分子中至少含有42个O原子
D.形成该蛋白质分子时相对分子质量减少了686
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为元素周期表中短周期主族非金属元素的一部分,下列说法不正确的是( )
X | Y |
Z | W |
A.W的原子序数可能是Y的两倍
B.Z的原子半径比Y的大
C.Y元素的非金属性比X元素的强
D.Z、W的氧化物对应的水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.向H2O中通人 NO2:3NO2+H2O═H++NO3﹣+2NO
B.向Na2SiO3溶液中通入少量SO2:Na2SiO3+SO2+H2O═H2SiO3↓+2Na++SO32﹣
C.用饱和纯減溶液洗涤试管中残留的苯酚:CO32﹣+2 ![]() →2
→2 ![]() +CO2↑+H2O
+CO2↑+H2O
D.等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42﹣+3Ba2++6OH﹣═3BaSO4↓+2Fe(OH)3↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com